
科目: 来源: 题型:
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( )
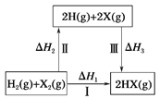
A.![]() △H3<0
△H3<0
B.反应热与反应的途径无关,所以![]()
C.![]() 键、
键、![]() 键、
键、![]() 键键能依次减小,所以途径Ⅱ吸收的热量依次增多
键键能依次减小,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】将A与B的混合物15mol放人容积为2L的密闭容器里,在一定条件下发生反应:2A(g)+3B(g)![]() C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1
C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物a为某种感冒药的同系物,其结构简式如图所示,下列说法正确的是( )
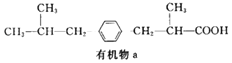
A.1mol有机物a最多可与4molH2发生加成反应
B.有机物a的化学式为C14H22O2
C.0.1mol有机物a与足量的NaHCO3溶液完全反应得到气体的体积为2.24L
D.有机物a苯环上的二氯代物有4种(不含立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏伽德罗常数,下列说法正确的是( )
A.标准状况下,560mL的氢气和氯气的混合气体充分反应后共价键数目为0.05NA
B.标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
C.常温常压下,1.5molHCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA
D.0.1mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
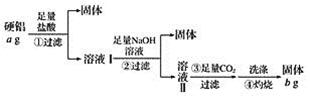
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知普通玻璃的成分为Na2O∶13%,CaO∶11.7%,SiO2∶75.3%。某玻璃厂现有石灰石500 t,纯碱2 400 t。计算上述原料能生产普通玻璃_________吨?
查看答案和解析>>
科目: 来源: 题型:
【题目】钾玻璃中含有18.4%的K2O,11.0%的CaO,70.6%的SiO2。
(1)计算三种氧化物的物质的量之比_________。
(2)若需制造5.1 t 钾玻璃,需用碳酸钾、石灰石、石英各_________吨?
(3)生产过程中释放出_________吨温室气体二氧化碳?
查看答案和解析>>
科目: 来源: 题型:
【题目】现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使___,灼烧后的坩埚应放在___上,不能直接放在桌面上。
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___、冷却结晶、___、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:____。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x值偏高,可能的原因是___。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
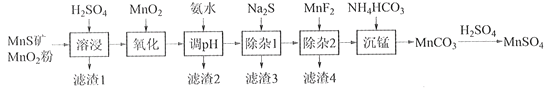
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com