
科目: 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且产物的成分与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
A. 某温度下,反应后c(Cl﹣):c(ClO﹣)=6,则溶液中c(ClO﹣):c(ClO3﹣)=1
B. 参加反应的氯气的物质的量等于0.5amol
C. 改变温度,反应中转移电子的物质的量n的范围:![]() amol<n<
amol<n<![]() amol
amol
D. 改变温度,产物中KClO3的最大理论产量为![]() amol
amol
查看答案和解析>>
科目: 来源: 题型:
【题目】在8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O反应中
(1)在上述化学方程式中用双线桥标明电子转移的方向和数目________。
(2)___发生了氧化反应,____是氧化剂。(填元素符号或化学式)
(3)上述反应中,还原剂和氧化剂的物质的量之比是___________;若生成1mol气体,则转移的电子数是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.![]() 、
、![]() 、
、![]() 三种核素最多可以组成2种水分子
三种核素最多可以组成2种水分子
B.核内中子数为N的R2+,质量数为A,则该粒子的核外电子数为:A-N-2
C.CH3OH和CH3-O-CH3分子组成相差一个CH2,所以互为同系物
D.按系统命名法,化合物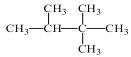 的名称为2,3,3-三甲基丁烷
的名称为2,3,3-三甲基丁烷
查看答案和解析>>
科目: 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
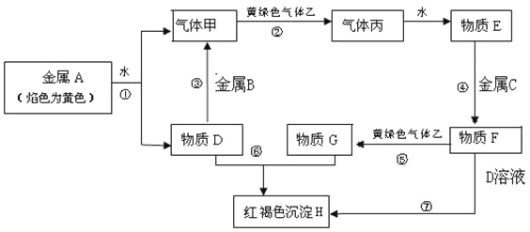
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_______、F________、H________。
(2)反应过程⑦可能观察到的实验现象______,反应的化学方程式为④_________。
(3)反应⑤的离子方程式为__________。
(4)反应①-⑦的7个反应属于氧化还原反应反应的有 ________(填选项代号)。
A.①②④⑤⑥ B.②③④⑥⑦ C.①②③④⑤⑦ D.全部
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的制备与工业生产相符的是
①NH3![]() NO
NO![]() HNO3
HNO3
②浓HCl![]() Cl2
Cl2 ![]() 漂白粉
漂白粉
③MgCl2(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
A. ①④⑤ B. ①③⑤ C. ②③④ D. ②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】目前锂电池的应用日益广泛,而废旧锂电池的回收利用是十分重要的课题。回收利用废旧锂电池的流程如下:

已知:①锂电池废料的主要成分是LiCoO2、铝、炭黑及其他杂质。
②“溶液A”中主要金属离子是Co2+、Li+,还含有少量Fe3+、Al3+、Cu2+。
请回答:
(1)步骤Ⅰ中铝溶解的离子方程式为_____;
步骤Ⅲ中LiCoO2固体溶解的化学方程式为_______;
(2)关于步骤Ⅱ,下列实验操作或说法合理的是_________
A.灼烧前,灼烧使用的蒸发皿洗净后不需要擦干,然后加入固体X进行灼烧
B.灼烧时需要用玻璃棒不断搅拌
C.灼烧至恒重是指前后两次称量所得质量之差不得超过一定的允许误差,这个允许误差一定为0.01g
D.在电解熔融的Al2O3制备金属铝时,通常需加入冰晶石(NaAlF6)以增强其导电性
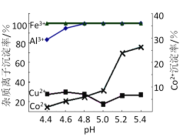
(3)步骤Ⅳ中除杂时可加入氨水调节溶液的pH,实验表明溶液A中各种金属离子的沉淀率随pH的变化如下图所示,则步骤Ⅳ中可除去的杂质离子是_________。
(4)步骤Ⅴ可采用酸碱滴定法测定碳酸锂的纯度。滴定原理如下:碳酸锂能够与盐酸反应生成氯化锂和二氧化碳,在碳酸锂未完全反应时,溶液保持中性(pH=7)。反应完全后,随着盐酸的继续滴入,溶液pH下降,以甲基红—溴甲粉绿为指示剂,用盐酸标准液滴定试样,用消耗盐酸标准滴定溶液的量来计算碳酸锂的含量。
①配制约0.30molL-1盐酸溶液不需要用到的仪器有________(填编号)
a.量筒b.电子天平c.漏斗d.烧杯e.容量瓶f.玻璃棒g.胶头滴管
②用0.3000molL-1盐酸标准溶液滴定,其中正确操作步骤的顺序为________
a.加入0.1-0.2mL甲基红—溴甲粉绿作指示剂;
b.煮沸去除CO2,再冷却到室温;
c.将试样置于250mL锥形瓶中,加入20mL水溶解;
d.用盐酸标准液滴定至试液由绿色变成酒红色;
e.继续滴定至酒红色(滴定突跃区域)即为终点
③碳酸锂的纯度可用下式计算:ω=![]() ,其中:ω—碳酸锂试样的纯度;m—碳酸锂试样的质量(g);c—盐酸标准液的浓度(molL-1)V1—试样滴定时消耗盐酸的体积(mL);V0—滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL),0.03694—与1.00mL标准盐酸(c=1.000molL-1)相当的碳酸锂的质量(g)。
,其中:ω—碳酸锂试样的纯度;m—碳酸锂试样的质量(g);c—盐酸标准液的浓度(molL-1)V1—试样滴定时消耗盐酸的体积(mL);V0—滴定空白溶液(指不加试样进行滴定)时标准盐酸消耗的体积(mL),0.03694—与1.00mL标准盐酸(c=1.000molL-1)相当的碳酸锂的质量(g)。
滴定空白溶液的目的是_________,上述滴定操作中,缺少“煮沸去除CO2,再冷却到室温”这个步骤,测定结果将_________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】把2.0 mol·L-1 CuSO4和1.0 mol·L1 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度c(CuSO4)=________;c(H2SO4)=________。
(2)混合液中H+和SO42-的物质的量浓度c(H+)=________;c(SO42-)=________。
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度c(Fe2+)=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(I),其合成路线如下: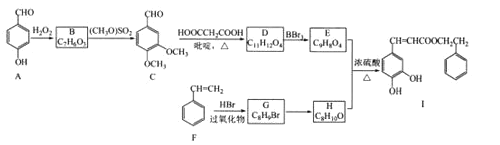
已知:①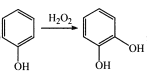 ;
;
②RCHO+HOOCCH2COOH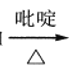 RCH=CHCOOH
RCH=CHCOOH
③当羟基与双键碳原子相连时,易发生转化:RCH=CHOH→RCHCHO
回答下列问题:
(1)化合物A的名称是____;F→G的反应类型是____。
(2)化合物B中含氧官能团的名称是___;G→H的反应所需试剂和条件分别是___、____。
(3)写出化合物I与足量NaOH溶液反应的化学方程式____。
(4)化合物W与E互为同分异构体,写出满足下列条件的W的结构简式____________。(不考虑立体异构,只需写出2个)
①化合物W与E所含官能团种类和数目完全相同,且苯环上有3个取代基;
②化合物W分子中苯环上有2种不同化学环境的氢。
(5)设计由CH3CH=CH2和HOOCCH2COOH为原料制备CH3CH2CH=CHCOOH的合成路线(无机试剂任选,合成路线常用的表示方式为:![]() )_____
)_____
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法正确的是
A. 石墨转变为金刚石的反应是吸热反应
B. 白磷比红磷稳定
C. S(g)=S(s) ΔH>0
D. H2(g)+I2(g)![]() 2HI(g) ΔH>0
2HI(g) ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com