
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. AlCl3溶液中滴加过量NH3·H2O:Al3+ + 4OH-= AlO2-+ 2H2O
B. 钠与水的反应:Na+2 H2O =Na++2OH-+H2↑
C. NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓
D. 氯气与水的反应:Cl2 + H2O = 2 H+ + ClO-+ Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
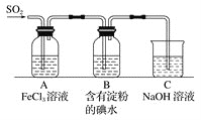
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】根据信息书写指定反应的方程式。
(1)请从下列溶液中选择合适的溶液完成指定转化(试剂可以重复选择)。溶液:NH3·H2O、FeSO4、Fe2(SO4)3、HCl、NaCl
①写出SO2→H2SO4的化学方程式:____;
②写出SO2→SO32-的离子方程式:____。
(2)三聚磷酸铝(AlH2P3O10·2H2O)是新一代无公害白色防锈颜料,可由膨润土(主要成分:Al2O3·4SiO2·3H2O;含杂质:FeO、Fe2O3、Na2O等)为原料经过如下流程制备。
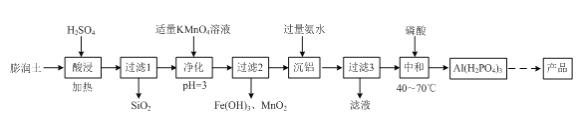
①“酸浸”时Al2O3·4SiO2·3H2O与硫酸反应的化学方程式为____。
②“净化”时发生反应的离子方程式为____。
③“沉铝”时发生反应的离子方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
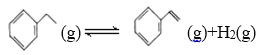
一段时间后,反应达到平衡,反应过程中测定的部分数据如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是
A.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B.反应在前20 min内的平均反应速率v(H2)=0.008 mol·L-1·min-1
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,体系的总压增大,平衡时苯乙烷的分压也增加。
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,则达到平衡前:v正<v逆
查看答案和解析>>
科目: 来源: 题型:
【题目】请按要求回答下列问题。
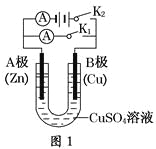
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
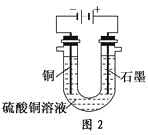
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
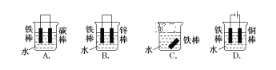
(1)下列哪个装置可防止铁棒被腐蚀___________。
(2)实际生产可在铁件的表面镀铜防止铁被腐蚀.装置示意图如图.请回答:

①A电极对应的金属是________(写元素名称),B电极的电极反应式是_________。
②镀层破损后,镀铜铁和镀锌铁中更容易被腐蚀的是___________。
A 镀铜铁 B 镀锌铁。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中放出的热量为______kJ。
(2)肼(N2H4)-空气燃料电池(产物为N2和H2O)是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:_______,负极的电极反应式:_______。
(3)如图是一个电解过程示意图。
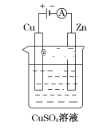
①锌片上发生的电极反应式是:____________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L.(假设空气中氧气体积分数为20%;Cu相对原子质量:64)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.金属和一定量的任意酸反应,只要放出2 g氢气,则转移的电子数为2NA
B.100 g 46%的乙醇水溶液中,含O—H键的数目为NA
C.48 g正丁烷和10 g异丁烷的混合物中共价键数目为11NA
D.含0.3 mol NH4NO3与a mol NH3·H2O的中性溶液中含0.3NA个NH![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com