
【题目】根据信息书写指定反应的方程式。
(1)请从下列溶液中选择合适的溶液完成指定转化(试剂可以重复选择)。溶液:NH3·H2O、FeSO4、Fe2(SO4)3、HCl、NaCl
①写出SO2→H2SO4的化学方程式:____;
②写出SO2→SO32-的离子方程式:____。
(2)三聚磷酸铝(AlH2P3O10·2H2O)是新一代无公害白色防锈颜料,可由膨润土(主要成分:Al2O3·4SiO2·3H2O;含杂质:FeO、Fe2O3、Na2O等)为原料经过如下流程制备。
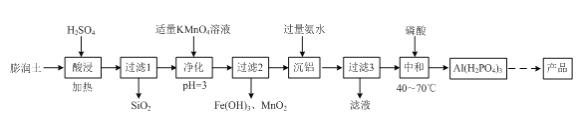
①“酸浸”时Al2O3·4SiO2·3H2O与硫酸反应的化学方程式为____。
②“净化”时发生反应的离子方程式为____。
③“沉铝”时发生反应的离子方程式为____。
【答案】SO2+Fe2(SO4)3+2H2O=== 2FeSO4+2H2SO4 SO2+2NH3·H2O=== SO32-+2NH4++H2O Al2O3·4SiO2·3H2O+3H2SO4![]() Al2(SO4)3+4SiO2+6H2O 3Fe2++MnO4-+7H2O===3Fe(OH)3↓+MnO2↓+5H+ Al3++3NH3·H2O===Al(OH)3↓+3NH4+
Al2(SO4)3+4SiO2+6H2O 3Fe2++MnO4-+7H2O===3Fe(OH)3↓+MnO2↓+5H+ Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【解析】
(1)①SO2→H2SO4,S元素化合价升高,被氧化,作还原剂,需加入氧化剂氧化SO2,以上溶液中Fe2(SO4)3可作氧化剂氧化SO2;
②SO2→SO![]() ,SO2与碱反应可生成SO
,SO2与碱反应可生成SO![]() ,以上溶液中NH3·H2O为碱;
,以上溶液中NH3·H2O为碱;
(2)膨润土(主要成分:Al2O34SiO23H2O;含少量杂质:FeO、Fe2O3、Na2O等)为原料制备三聚磷酸铝[AlH2P3O102H2O],加稀硫酸,Al2O3、FeO、Fe2O3、Na2O转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加高锰酸钾溶液,Fe2+被氧化为Fe3+,同时生成的锰离子可再被高锰酸钾氧化成二氧化锰,调节pH值,得氢氧化铁沉淀和二氧化锰沉淀,滤液中主要含有硫酸铝及少量硫酸钠杂质,再加入氨水,得氢氧化铝沉淀,过滤,滤液3中含有硫酸钠和硫酸铵还有氨水,氢氧化铝中加入磷酸,缩合可得三聚磷酸铝,据此解答。
(1)①SO2→H2SO4,S元素化合价升高,被氧化,作还原剂,需加入氧化剂氧化SO2,以上溶液中Fe2(SO4)3可作氧化剂氧化SO2,发生反应的化学方程式为:SO2+Fe2(SO4)3+2H2O=== 2FeSO4+2H2SO4;
故答案为:SO2+Fe2(SO4)3+2H2O=== 2FeSO4+2H2SO4;
②SO2→SO32-,SO2与碱反应可生成SO32-,以上溶液中NH3·H2O为碱,发生反应的离子方程式为:SO2+2NH3·H2O=== SO32-+2NH4++H2O;
故答案为:SO2+2NH3·H2O=== SO32-+2NH4++H2O;
(2)膨润土(主要成分:Al2O34SiO23H2O;含少量杂质:FeO、Fe2O3、Na2O等)为原料制备三聚磷酸铝[AlH2P3O102H2O],加稀硫酸,Al2O3、FeO、Fe2O3、Na2O转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+、Na+,加高锰酸钾溶液,Fe2+被氧化为Fe3+,同时生成的锰离子可再被高锰酸钾氧化成二氧化锰,调节pH值,得氢氧化铁沉淀和二氧化锰沉淀,滤液中主要含有硫酸铝及少量硫酸钠杂质,再加入氨水,得氢氧化铝沉淀,过滤,滤液3中含有硫酸钠和硫酸铵还有氨水,氢氧化铝中加入磷酸,缩合可得三聚磷酸铝,
①加入稀硫酸“酸浸”时,Al2O3、FeO、Fe2O3、Na2O转化为离子,SiO2不溶于硫酸,则Al2O3·4SiO2·3H2O与硫酸反应的化学方程式为Al2O3·4SiO2·3H2O+3H2SO4![]() Al2(SO4)3+4SiO2+6H2O;
Al2(SO4)3+4SiO2+6H2O;
故答案为:Al2O3·4SiO2·3H2O+3H2SO4![]() Al2(SO4)3+4SiO2+6H2O;
Al2(SO4)3+4SiO2+6H2O;
②“净化”时加入高锰酸钾溶液,Fe2+被氧化为Fe3+,同时生成的锰离子可再被高锰酸钾氧化成二氧化锰,调节pH值,得氢氧化铁沉淀和二氧化锰沉淀,发生反应的离子方程式为3Fe2++MnO4-+7H2O===3Fe(OH)3↓+MnO2↓+5H+;
故答案为:3Fe2++MnO4-+7H2O===3Fe(OH)3↓+MnO2↓+5H+;
③滤液中铝元素是以铝离子的形式存在的,加入过量氨水,反应生成氢氧化铝,发生反应的离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3·H2O===Al(OH)3↓+3NH4+。


科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则混合气体中CO2、H2和CO的体积比为( )
A.29:8:13B.22:1:14C.13:8:29D.26:8:57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
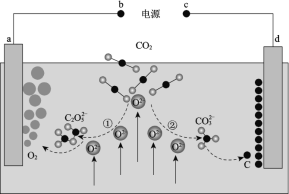
下列说法不正确的是
A.c为电源的负极
B.①②中,捕获CO2时碳元素的化合价均未发生变化
C.d极的电极反应式为![]() + 4e = C + 3O2
+ 4e = C + 3O2
D.转移1mol电子可捕获CO2 2.8 L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.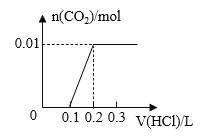 B.
B.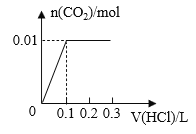
C.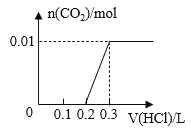 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶久置的白色亚硫酸钾粉末,为确定其是否被氧化及其成分,元素分析表明粉末中钾元素和硫元素的质量比为39∶16,下列结论正确的是( )
A.根据元素分析结果推测该粉末为纯净物
B.将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是硫酸钾
C.将粉末加入盐酸中,产生气泡,证明原粉末是亚硫酸钾
D.将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成 ,证明原粉末是硫酸钾和亚硫酸钾的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
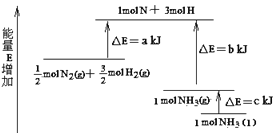
A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢中的硫元素化合价为______,在化学反应中易_____(填得或失)电子,因此具有______性。硫化氢可燃,氧气充足情况下,硫化氢燃烧产生淡蓝色火焰,化学方程式_________;氧气不足情况下,硫化氢燃烧化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com