
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
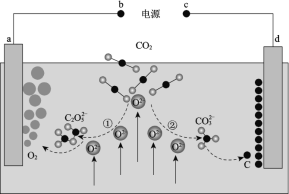
下列说法不正确的是
A.c为电源的负极
B.①②中,捕获CO2时碳元素的化合价均未发生变化
C.d极的电极反应式为![]() + 4e = C + 3O2
+ 4e = C + 3O2
D.转移1mol电子可捕获CO2 2.8 L(标况下)
【答案】D
【解析】
过程①为2CO2+O2-=![]() ,a极电极反应为2
,a极电极反应为2![]() -4e-=O2↑+4CO2,a电极失电子,为阳极,则b电极为电源的正极;过程②为CO2+O2-=
-4e-=O2↑+4CO2,a电极失电子,为阳极,则b电极为电源的正极;过程②为CO2+O2-=![]() ,d极电极反应为
,d极电极反应为![]() +4e-=C+3O2-,d电极得电子,为阴极,则c电极为电源的负极。
+4e-=C+3O2-,d电极得电子,为阴极,则c电极为电源的负极。
A.由以上分析可知,c为电源的负极,A正确;
B.①②中,捕获CO2时发生的反应分别为2CO2+O2-=![]() 、CO2+O2-=
、CO2+O2-=![]() ,碳元素的化合价均未发生变化,B正确;
,碳元素的化合价均未发生变化,B正确;
C.d极为阴极,![]() 得电子生成C 和O2,电极反应式为
得电子生成C 和O2,电极反应式为![]() + 4e= C + 3O2,C正确;
+ 4e= C + 3O2,C正确;
D.将阴、阳极发生的电极反应加和,便得到总反应式为:CO2![]() C+O2↑,转移4mol电子时,消耗1molCO2,则转移1mol电子可捕获CO2 的体积为
C+O2↑,转移4mol电子时,消耗1molCO2,则转移1mol电子可捕获CO2 的体积为![]() =5.6 L(标况下),D不正确;
=5.6 L(标况下),D不正确;
故选D。


科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
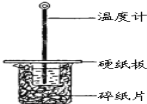
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;

(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化产物与还原产物为同一种物质的是
A.KClO3 + 6HCl = KCl+ 3Cl2↑+ 3H2OB.2Na+2H2O=2NaOH+H2↑
C.2Na2O2+2H2O=4NaOH+O2↑D.I2+2Na2S2O3 = 2NaI + Na2S4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。
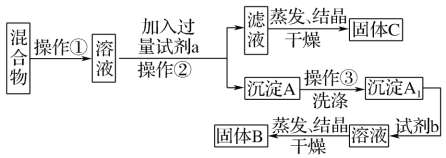
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。试回答下列问题:
(1)操作①的名称是____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是____。
(3)加入试剂a所发生反应的化学方程式为_____。加入试剂b所发生反应的离子方程式为_____。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?_____(若能,此问不用回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息书写指定反应的方程式。
(1)请从下列溶液中选择合适的溶液完成指定转化(试剂可以重复选择)。溶液:NH3·H2O、FeSO4、Fe2(SO4)3、HCl、NaCl
①写出SO2→H2SO4的化学方程式:____;
②写出SO2→SO32-的离子方程式:____。
(2)三聚磷酸铝(AlH2P3O10·2H2O)是新一代无公害白色防锈颜料,可由膨润土(主要成分:Al2O3·4SiO2·3H2O;含杂质:FeO、Fe2O3、Na2O等)为原料经过如下流程制备。
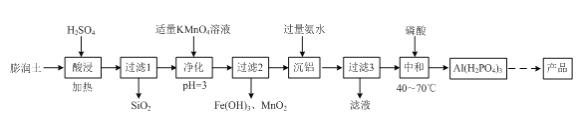
①“酸浸”时Al2O3·4SiO2·3H2O与硫酸反应的化学方程式为____。
②“净化”时发生反应的离子方程式为____。
③“沉铝”时发生反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,某溶液X中所含ClO2浓度(g·L-1)的实验测定步骤如下:步骤1. 配制Na2S2O3溶液:准确称取1.984 0 g Na2S2O3·5H2O,用新煮沸并冷却的蒸馏水配成100.00 mL溶液。步骤2. 准确移取1.00 mL溶液X加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+===5I2+2Cl-+4H2O),在暗处放置5 min。步骤3. 向步骤2的锥形瓶的反应液中加入1 mL淀粉溶液作指示剂,再向其中滴加步骤1配制的Na2S2O3溶液(发生反应I2+2Na2S2O3===2NaI+Na2S4O6),至恰好完全反应时消耗Na2S2O3溶液25.00 mL。
(1)步骤1中所配Na2S2O3溶液的物质的量浓度为____mol·L-1,所用玻璃仪器除烧杯、胶头滴管外还有____。(2)配制Na2S2O3溶液时,蒸馏水需煮沸的原因是____。
(3)计算溶液X中所含ClO2浓度(g·L-1)(写出计算过程)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.500℃左右比常温下更有利于合成氨
B.红棕色的NO2,加压后颜色先变深后变浅
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com