
科目: 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )
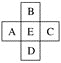
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是
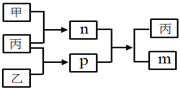
A. 原子半径:W<X<Y B. 非金属性:Y>Z>X
C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

(1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→________________→B;为使NH3与Cl2更充分混合,Cl2应从C装置的__口进入(填“x”或“y”).
(2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是__________________.
(3)装置A中发生反应的离子方程式为_______________________________.
(4)装置B中圆底烧瓶内的试剂为______________(填名称).
(5)装置D的作用是____________________________.
(6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
ii:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
iii:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
化学键 | H—H | C=O | C≡O | H—O |
E/KJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=___kJ·mol-1。已知ΔH1=-63kJ·mol-1,则ΔH3=___kJ·mol-1。
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:
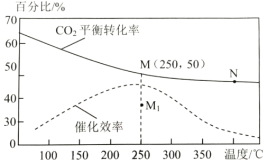
①下列说法不正确的是(__________)
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为___,250℃时反应的平衡常数Kp=___(MPa)-2(保留三位有效数字);
③若要进一步提高甲醇产率,可采取的措施有___(写两条即可)
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:___。
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
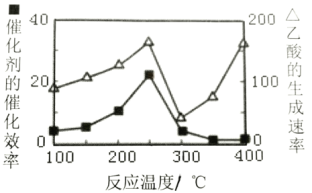
250~300℃时,乙酸的生成速率降低的主要原因是___。
300~400℃时,乙酸的生成速率升高的主要原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g),下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g),下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入He以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入He以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目: 来源: 题型:
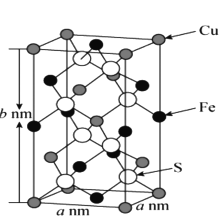
【题目】黄铜矿是工业炼铜的原料,含有的主要元素是硫、铁、铜,请回答下列问题。
(l)基态硫原子中核外电子有____种空间运动状态。Fe2+的电子排布式是 ___。
(2)液态SO2可发生白偶电离2SO2=SO2++SO32-,SO32-的空间构型是 ___,与SO2+互为等电子体的分子有____(填化学式,任写一种)。
(3)CuCl熔点为426℃,融化时几乎不导电,CuF的熔点为908℃,沸点1100℃,都是铜(I)的卤化物,熔沸点相差这么大的原因是 ___。
(4)乙硫醇(C2H5SH)是一种重要的合成中间体,分子中硫原子的杂化形式是____。乙硫醇的沸点比乙醇的沸点____(填“高”或“低”),原因是____。
(5)黄铜矿主要成分X的晶胞结构及晶胞参数如图所示,X的化学式是 ___,其密度为 ___g/cm3(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com