
科目: 来源: 题型:
【题目】(1)材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于________(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是________(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y,其中x,y的数值分别是________(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是________(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是________结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
(2)某品牌果冻标签如图所示。回答下列问题:

①食品添加剂中,属于无机盐的是______(填化学式)。
②属于着色剂的是诱惑红和______;属于防腐剂的是______。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式______。
(3)化学与科学技术、生产生活及环境保护等密切相关。
①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是______;严格整治畜禽养殖场污染,主要是为减少______和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式____________________________________________________。
③阿司匹林作为一种药物,主要具有______作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置或操作设计正确,且能达到实验目的的是
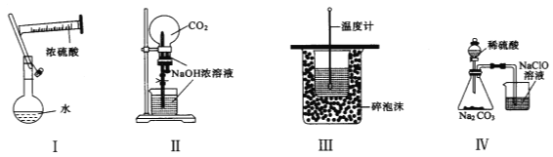
A.实验Ⅰ:配制一定物质的量浓度的稀硫酸
B.实验Ⅱ:用二氧化碳做喷泉实验
C.实验Ⅲ:进行中和热的测定
D.实验Ⅳ:验证酸性强弱H2SO4>H2CO3>HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO![]() =SO
=SO![]() +2HCO3-
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】含铬化合物及铬合金用途非常广泛。回答下列问题:
⑴基态Cr原子价电子排布式为___;第三电离能I3(Cr)=2987kJ·mol-1,I3(Mn)=3248kJ·mol-1,I3(Cr)<I3(Mn),其原因是___。
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___法区分晶体、准晶体和非晶体。
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为___、___、___。
②写出一种与SCN-互为等电子体的分子:___(填化学式)。
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___,两个配体NH3、SCN-中,中心原子杂化类型依次为___、___。
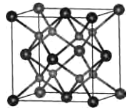
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为___pm,Cr-O键的键长为___pm;设NA为阿伏加德罗常数的值,则CrO2的密度为___g·cm-3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)________(填“>”“<”或“=”)v(逆),随后v(正)逐渐______(填“增大”或“减小”,下同),v(逆)逐渐________,反应达到平衡时,V(正)_______(填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则V(N2)=____v'(H2)。
(3)下列措施中不能加快反应速率的是___________(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氦气
(4)写出合成氨反应N2+3H2![]() 2NH3的平衡常数表达式:_____________________________。
2NH3的平衡常数表达式:_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组在T1温度下,向容积为1L的恒容密闭容器中,同时通入0.1mol CO(g)和0.1mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。

(1)0~10min内,CO的平均反应速率为_____________
(2)T1温度下,该反应的平衡常数K为_______________(用分数表示)。
(3)已知:I.H2的燃烧热 △H=-285.8 kJ·mol-1;
II.CO的燃烧热 △H=-283 kJ·mol-1;
III.H2O(g)![]() H2O(l) △H=-44 kJ·mol-1。则a=______________
H2O(l) △H=-44 kJ·mol-1。则a=______________
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将_______ (填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了证明铁与稀硝酸反应产生一氧化氮,某校兴趣小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;F为一个空的蒸馏烧瓶;E是用于鼓入空气的双连打气球。
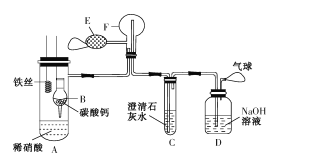
回答下列问题:
(l)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,一段时间后,C中澄清石灰水____(填现象)时,将B装置上提,使之与稀硝酸分离。
(2)将A中铁丝放入稀硝酸中,装置A中产生________(填“无色”或“红棕色”)气体。用E向F中鼓入空气后,烧瓶F内发生反应的化学方程式为 ___, 一段时间后,C中的现象为____。
(3)若反应后向A中溶液滴加KSCN溶液,溶液不变红色,则铁丝与稀硝酸反应的离子方程式为________
查看答案和解析>>
科目: 来源: 题型:
【题目】脱硝技术是处理氮氧化物的有效方法之一。在1L的恒容密闭容器中充入2mol NH3、1mol NO和1mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)上述反应中___________(填字母)。
A. △S>0,△H>0 B. △S>0,△H<0 C. △S<0,△H>0 D. △S<0,△H<0
(2)T1_______(填“>”“<”或“=”)T2,理由是___________________________________________
(3)T1K下,0~20min内v(NO)=______________
(4)T2K下,NO2的平衡转化率为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】CaS在环境保护、制备电致发光材料等方面用途非常广泛。回答下列问题:
(1)制取CaS的反应如下:
反应(I):CaSO4(s)+2C(s)![]() CaS(s)+2CO2(g) △H1
CaS(s)+2CO2(g) △H1
反应(II):CaCO3(s)+H2S(g)![]() CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
CaS(s)+H2O(g)+CO2(g) △H2=+165kJ·mol-1
①若在恒温恒容密闭容器中只发生反应(I),达到平衡时向容器中通入少量CO2,则反应再次达到平衡时c(CO2)将___(填“增大”“减小”或“不变”)。
②已知下列热化学方程式:.
i:S2(g)+CaSO4(s)![]() CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
CaS(g)+2SO2(g) △H=+240.4kJ·mol-1
ii:2SO2(g)+4CO(g)=S2(g)+4CO2(g) △H=+16.0kJ·mol-1
iii:C(s)+CO2(g)=2CO(g) △H=+172.5kJ·mol-1
则反应(I)的△H1=___kJ·mol-1。
③反应(II)的△S___(填“>”“<”或“=”)0。若反应(II)在恒温恒容密闭容器中进行,能说明该反应已达到平衡状态的是___(填字母)。
A.v(H2O)正=v(CO2)正
B.容器中气体总压强不再随时间变化
C.容器中同时存在H2S(g)、CO2(g)和H2O(g)
D.单位时间内断裂H-S键与断裂C=O键数目相等
(2)CaS能被许多物质氧化,有关反应的lgKp与温度关系如图(Kp为以分压表示的平衡常数;分压=总压×物质的量分数;图中数据由压强单位为kPa得出)。
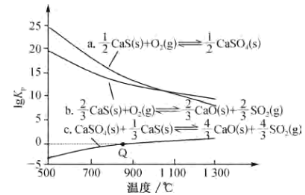
①属于吸热反应的是___ (填“a”“b”或“c”)。
②相同温度下,反应a、b、c的lgKp(a)、lgKp(b)、lgKp(c)之间满足的关系是lgKp(c)=___。
③反应c在Q点时:p(SO2)=___kPa,以浓度表示的平衡常数Kc=___Kp[用R、T表示;已知气体的压强、体积、温度满足pV=nRT(n为气体的物质的量,R为恒量)]。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用如下实验探究SO2的性质。回答下列问题:
(l)甲同学用废铜屑与浓硫酸为原料制取SO2,发生反应的化学方程式为 ________;SO2是____氧化物,故产生的SO2尾气可用 ____填化学式)溶液吸收。
(2)乙同学向盛有2 mL氯水的试管中通人SO2 一段时间后溶液褪色。SO2 表现出的性质是____,发生反应的离子方程式为____。
(3)丙同学的实验装置如图所示,装置A中SO2和O2的流速比约为____;加热后,玻璃管中的反应方程式为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com