
科目: 来源: 题型:
【题目】下图是我国学者研发的高效过氧化氢一尿素电池的原理装置:
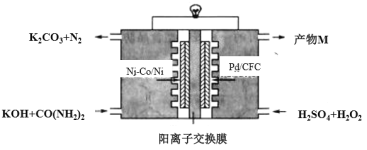
该装置工作时,下列说法错误的是
A.Ni-Co/Ni极上的电势比Pd/CFC极上的低
B.向正极迁移的主要是K+,产物M主要为K2SO4
C.负极反应为:CO(NH2)2+8OH–-6e–=CO32–+N2↑+6H2O
D.Pd/CFC极上发生反应:H2O2+2e–=2OH–
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4,下列说法中正确的是
2ClO2+2NaHSO4,下列说法中正确的是
A. NaClO3在反应中失去电子
B. SO2在反应中被氧化
C. H2SO4在反应中作氧化剂
D. 1 mol氧化剂在反应中得到2 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如图所示:
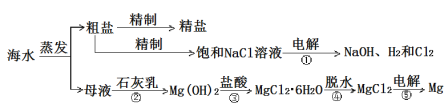
(1)写出镁原子的结构示意图:_______。在反应①→⑤中属于氧化还原反应的是______。(填序号)
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、________溶液;③_________;④滤液中加适量盐酸;⑤__________。(请补全缺少的实验步骤或试剂)
(3)某同学利用反应①原理制备氯气,将400 mL 5.0 mol·L-1NaCl溶液进行电解,则理论上最多可制得标准状况下氯气的体积为_____L。
(4)实验室模拟Mg的制取流程时,用11.3 mol·L-1的浓盐酸配置反应③所需要的0.5 mol·L-1稀盐酸100 ml,需要用量筒量取浓盐酸________ml,接下来的配置过程除了玻璃棒和烧杯外,还需要用到的玻璃仪器有_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________,烧杯间填满碎塑料泡沫的作用是______.
(2)大烧杯上如不盖硬纸板,则求得的中和热数值______________(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热的数值______(填“相等”或“不相等”).
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1L0.lmol/L的Na2SiO3溶液中含阴离子总数为0.1NA个
B.0.1mol的2H37Cl分子的中子数是2.1NA
C.7.8gNa2O2与足量水充分反应转移的电子数目为0.2NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有4NA个S-S键
,含有4NA个S-S键
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+![]() O2(g)=H2O(g),反应过程中能量变化如图所示,请回答下列问题。
O2(g)=H2O(g),反应过程中能量变化如图所示,请回答下列问题。

(1)a、c分别代表什么意义?
a:____________________;c:____________________。
(2)该反应ΔH_________(填“>”“<”或“=”)0。
查看答案和解析>>
科目: 来源: 题型:
【题目】铋酸钠(NaBiO3)常用作Mn2+鉴定的强氧化剂,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如图:
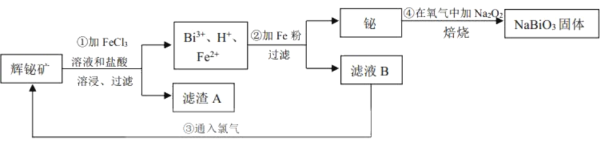
己知:①NaBiO3是一种难溶于水的物质
②BiCl3极易水解生成不溶性的BiOCl沉淀
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有___(填标号)。
a.加入足量的蒸馏水 b.搅拌 c.粉碎矿石 d.降低温度
(2)溶浸时通常加入FeCl3溶液和浓盐酸,加入的浓盐酸需过量的目的是___,滤渣A的主要成分为___(填化学式)。
(3)反应④的化学方程式为___。
(4)NaBiO3可在酸性介质中将Mn2+氧化为MnO![]() ,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
(5)实验室为了测定NaBiO3样品的纯度,需要配制250mL0.500mol/LFeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要___。
(6)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀释至100mL,取出20.00mL溶液,然后用新配制的0.500mol/LFeSO4溶液进行滴定,滴定完成后消耗24.80mLFeSO4溶液。则该样品中NaBiO3纯度为___%(结果保留小数点后一位)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在298 K、1.01×105 Pa,将22 g CO2通入0.75 L 1.0 mol·L-1NaOH溶液中充分反应,测得反应放出的热量为a kJ。已知该条件下1 mol CO2通入1 L 2.0 mol·L-1NaOH溶液中充分反应放出的热量为b kJ。则CO2与NaOH反应生成NaHCO3的热化学方程式为( )。
A. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=-(2b-a) kJ·mol-1
B. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=+(4a-b) kJ·mol-1
C. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
NaHCO3(aq) ΔH=-(4a-b) kJ·mol-1
D. CO2(g)+NaOH(aq)![]() NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
NaHCO3(aq) ΔH=+(2b-a) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】把2.5mol A和2.5mol B混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1mol D,下列叙述中错误的是
xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1mol D,下列叙述中错误的是
A. x=4
B. 达到平衡状态时容器内气体的压强与起始时压强比为6:5
C. 5s内B的反应速率V(B)=0.05mol·L-1·s-1
D. 达到平衡状态时A的转化率为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com