
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.只用溴水即可鉴别苯酚溶液、2,4-已二烯和甲苯
B. 的二氯代物共有6种(不考虑立体异构)
的二氯代物共有6种(不考虑立体异构)
C.![]() 的名称为2-甲基-2-乙基-1-丁醇
的名称为2-甲基-2-乙基-1-丁醇
D.碳酸亚乙酯(![]() )可与热的
)可与热的![]() 溶液反应
溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。抗击疫情要戴口罩,勤洗手,下列有关说法正确的是( )
A.新型冠状病毒可能通过气溶胶传播,说明病毒的粒子直径可能在纳米级范围内
B.为增强消毒效果可将医用消毒酒精与84消毒液混合使用
C.甲醛和戊二醛可杀灭多种病原体,可用于空气、餐具的消毒
D.可用铝制容器配制过氧乙酸(![]() )消毒剂
)消毒剂
查看答案和解析>>
科目: 来源: 题型:
【题目】铋(83号元素)主要用于制造合金,铋合金具有凝固时不收缩的特性,用于铸造印刷铅字和高精度铸型。湿法提铋新工艺以氧化铋渣(主要成分为![]() ,含有
,含有![]() 、
、![]() 、
、![]() 杂质)为原料提Bi的工艺流程如下:
杂质)为原料提Bi的工艺流程如下:
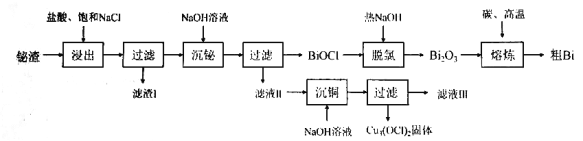
已知:Ⅰ.![]() 不溶于水,加热至700℃就分解生成
不溶于水,加热至700℃就分解生成![]() ,
,![]() 的沸点为447℃。
的沸点为447℃。
Ⅱ.25℃时,![]() ;
;![]() 。
。
回答下列问题:
(1)铋在元素周期表中的位置为___________________。
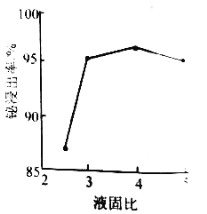
(2)“浸出”时,在盐酸浓度![]() 、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
、浸出温度70℃、浸出时间2h及不同浸出液固比条件下进行浸出实验,浸出率与液固比的关系如图所示,最合适的液固比应选__________。
(3)“滤渣Ⅰ”的成分为_____________(填化学式)。
(4)“脱氯”的化学方程式为___________________。
(5)“沉铜”时,向“滤液Ⅱ”中加入NaOH溶液调节pH,促进![]() 水解生成
水解生成![]() ,则此过程中
,则此过程中![]() 水解的离子方程式为_________________________。若“滤液Ⅱ”中
水解的离子方程式为_________________________。若“滤液Ⅱ”中![]() 为
为![]() ,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀
,当加入等体积的NaOH溶液时,pH恰好为6,出现沉淀![]() ,此时
,此时![]() 的去除率为________(忽略溶液体积变化)。
的去除率为________(忽略溶液体积变化)。
(6)“滤液Ⅲ”经加热浓缩后可返回____________工序循环使用。
查看答案和解析>>
科目: 来源: 题型:
【题目】将11.5g钠、9g铝、28g铁分别投入200![]() 1
1![]() 的盐酸中,下列说法正确的是( )
的盐酸中,下列说法正确的是( )
A.钠与盐酸反应最剧烈,产生的气体最多
B.铝与盐酸反应的速率仅次于钠,但产生的气体最多
C.铁与盐酸反应产生的气体比钠多
D.反应结束时产生的气体一样多
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,将0. 3 mol CO2通入盛有23.4 gNa2O2的容器中,一段时间后排出气体,所得固体的质量为29. 0 g,则参加反应的CO2的物质的量与产物Na2CO3的质量分别为( )
A.0. 3 mol 29. 0 gB.0. 3 mol 21. 2 g
C.0. 2 mol 21. 2 gD.0. 2 mol 29. 0 g
查看答案和解析>>
科目: 来源: 题型:
【题目】白杨素对肿瘤细胞有独特的杀伤作用,一种以甲苯、氯苯、丙烯酸为原料合成白杨素的路线如下:
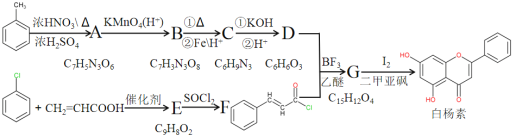
回答下列问题:
(1) A的名称是:__________________。
(2) C和D中不同化学环境的氢原子都为两种,则C和D的结构简式分别为:______、______。
(3) “D+F→G”的方程式为:_____________,物质E经“E→F”过程后再与D反应可大大减少副产物__________的生成。
(4) “G→白杨素”的反应类型为:_____________。试剂I2的选择是整个合成路线的关键。I2不能用更易结合H原子的Cl2替代的原因是:___________________。
(5) 下列关于白杨素的说法正确的是:_________。
A.白杨素的分子式C15H9O4
B.白杨素遇FeCl3溶液发生显色反应
C.与溴水反应,1mo白杨素最多消耗3molBr2
D.与足量H2发生加成反应后,白杨素分子中官能团种类减少1种
(6) E有多种同分异构体,满足分子中含有苯环,且能与4倍物质的量的银氨溶液反应的种类数有_________种,其中不同化学环境的氢原子有4种的结构简式为:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯是一种高效消毒剂,通常状况下二氧化氯易溶于水,沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质稳定的气体按一定比例稀释,以防爆炸。某实验小组在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,实验装置如图所示:
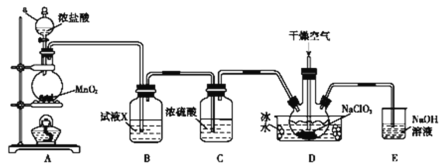
(1)仪器a的名称为___________,装置A中反应的化学方程式为___________。
(2)试剂X是___________。
(3)装置D内发生反应的化学方程式为___________。
(4)工业上也常用盐酸或双氧水还原NaClO3制备ClO2,相比之下用双氧水制备ClO2方法更优,可能的原因是_____________________________。
(5)装置E中主要反应的离子方程式为____________________。
(6)已知NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
①请完成实验室利用NaClO2溶液制得NaClO2晶体的操作步骤:A.减压,55℃蒸发结晶;B.趁热过滤;C.用38~60℃的温水洗涤;D.低于60℃干燥,得到产品。
②取上述所得产品2.50g溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.500mol·L-1Na2S2O3标准液滴定至终点。进行3次实验后,平均用去标准液18.80mL,试计算NaClO2产品的纯度__________(已知:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目: 来源: 题型:
【题目】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌原子的价电子排布图:____________________________________________
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是________________
(3)Cd2+与NH3等配体形成配离子。1 mol [Cd(NH3)4]2+含___________mol σ键。该配离子中三种元素的电负性大小关系是:_______________________
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为________
(5)锆晶胞如图1所示,这种堆积方式称为______________________,镉晶胞如图2所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。
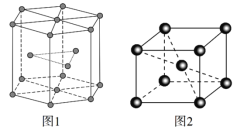
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一固定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A.SO2和SO3共2 mol
B.生成SO3 2 mol
C.放出197 kJ热量
D.含氧原子共12 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究Na2O2与H2O的反应,进行了如下实验:
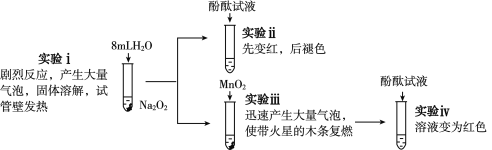
有关说法不正确的是( )
A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑
B.实验ⅲ中MnO2做H2O2分解反应的催化剂
C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成
D.综合实验ⅱ和ⅲ可以说明使酚酞褪色的是O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com