
科目: 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】苯丁酸氮芥是氮芥类抗癌药的代表物,其合成路线如图所示:
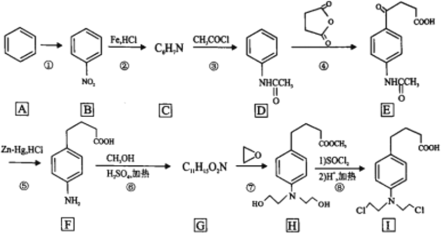
回答下列问题:
(1)反应①所需的试剂和条件是______________,B中的官能团名称是______________
(2)C的结构简式为______________。
(3)写出具有苯环结构,既能发生银镜反应又能发生水解反应的D的同分异构体的结构简式______________。(不考虑立体异构,只需写出3个)
(4)②的反应类型是______________。
(5)写出F到G的反应方程式______________。
(6)设计由苯和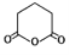 制备
制备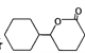 的合成路线(无机试剂任选)。______________
的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】二苯甲酮广泛应用于药物合成,同时也是有机颜料、杀虫剂等的重要中间体。实验室以苯与苯甲酰氯为原料,在AlCl3作用下制备二苯甲酮的实验流程如下图所示:

相关物理常数和物理性质如下表:
名称 | 相对分 子质量 | 密度/g·cm-3 | 熔点/oC | 沸点/oC | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
苯甲酰氯 | 140.5 | 1.22 | 1 | 197 | 遇水分解 |
无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
二苯甲酮 | 182 | 1.11 | 48.5 | 305(常压) | 难溶水,易溶苯 |
已知:反应原理为: 。该反应剧烈放热。
。该反应剧烈放热。
回答下列问题:
(1)反应装置如图所示(加热和夹持装置已略去),迅速称取7.5 g无水三氯化铝放入三颈瓶中,再加入30 mL无水苯,搅拌,缓慢滴加6 mL新蒸馏过的苯甲酰氯。反应液由无色变为黄色,三氯化铝逐渐溶解。混合完后,保持50℃左右反应1.5~2 h。
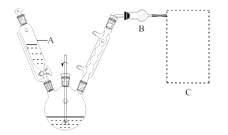
仪器A的名称为_______。装置B作用为_______。缓慢滴加苯甲酰氯的原因是______。能作为C中装置的是_______(填标号)。

(2)操作X为___________。
(3)NaOH溶液洗涤的目的是_____________。
(4)粗产品先经常压蒸馏除去__________,再减压蒸馏得到产品。
(5)当所测产品熔点为________时可确定产品为纯品。已知实验最终所得纯品8.0 g,则实验产率为_________ %(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
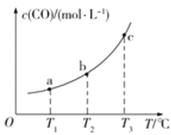
①该反应△H_____________0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_____________K2(填“>”、“<”或“=”)。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
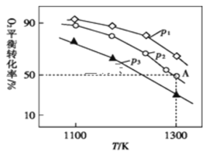
①p1、p2、p3的大小:___________。
②若初始时通入7.0molO2,p2为7.0kPa,则A点平衡常数Kp=___________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
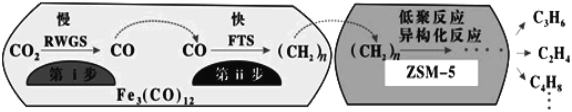
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是:___________
②下列说法正确的是______;
a.第ⅰ步的反应为:CO2+H2![]() CO+H2O
CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是( )
A.C原子外围电子排布图:![]() B.硫原子结构示意图:
B.硫原子结构示意图:![]()
C.二氧化硅的分子式:SiO2D.Na原子的电子排布式:1s22s22p63s1
查看答案和解析>>
科目: 来源: 题型:
【题目】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图。
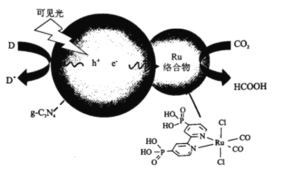
(1)基态碳原子的价电子排布图为___________。
(2)1molHCOOH中含有的σ键数目为___________,HCOOH的沸点比CO2高的原因为___________。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___________。
(4)Ru络合物中与Ru配位的原子有N、___________。
(5)一类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
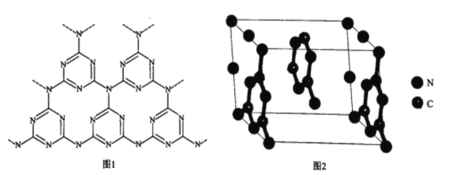
①g-C3N4中氮原子的杂化类型是______________。
②根据图2,在图1中用平行四边形画出一个最小重复单元。______________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为______________g.cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,3种物质的电离平衡常数如下表:
物质 | HCOOH | CH3COOH | NH3·H2O |
电离平衡常数K | 1.77×104 | 1.75×105 | 1.76×105 |
下列说法不正确的是
A.等物质的量浓度时,溶液pH:HCOONa<CH3COONa
B.pH均为3时,溶液浓度:c(HCOOH)>c(CH3COOH)
C.HCOOH溶液与氨水混合,当溶液pH=7时,c(HCOO-)=c(NH4+)
D.等物质的量浓度等体积的CH3COOH溶液和氨水混合,溶液pH约为7
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.4L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:

(1)该混合液中,NaCl的物质的量为__mol,含溶质MgCl2的质量为__g。
(2)该混合液中CaCl2的物质的量为__mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为__mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com