
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:

(1)从“正极”可以回收的金属有___________________。
(2)“碱溶”时Al箔溶解的离子方程式_________________________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为_________mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO![]() )=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
)=________mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。放电时,正极反应式为________________________。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-= SnCl![]() +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2= SnCl![]() +Hg2Cl2
+Hg2Cl2
6Fe2++Cr2O![]() +14H+ = 6Fe3++2Cr3++7H2O
+14H+ = 6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是________________________。
②磷酸亚铁锂电池中铁的含量为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是

A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
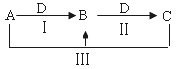
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
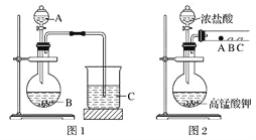
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A.用排饱和食盐水的方法收集氯气
B.合成氨工业选择高温
C.开启啤酒瓶后,瓶中马上泛起大量泡沫
D.在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释 ④KClO3分解制O2⑤生石灰跟水反应生成熟石灰⑥石灰石高温分解⑦铝热反应⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O=CO+H2 ⑩Al与盐酸反应
A. ②③④⑥⑦⑧⑨ B. ②④⑥⑧⑨ C. ①②④⑥⑧ D. ②③④⑧⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.100mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)___。
(2)滴定操作中,左手___,右手___,眼睛___。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果___(填“偏高”、“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.可逆反应3A(g)![]() 3B(?)+C(?) △H>0,达到化学平衡后,进行下列操作。
3B(?)+C(?) △H>0,达到化学平衡后,进行下列操作。
(1)升高温度,用“变大”“变小”“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量___;
②若B、C都不是气体,气体的平均相对分子质量___;
③若B是气体,C不是气体,气体的平均相对分子质量___;
(2)如果平衡后温度保持不变,将容器体积增大一倍,新平衡时A的浓度是原来的50%,判断B的状态是___态,C的状态是__态。
(3)某密闭容器中放入一定量的NO2,发生反应2NO2![]() N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是___。
N2O4(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是___。
A.通入N2 B.通入NO2 C.通入N2O4 D.升高温度
Ⅱ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K 和温度T的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K 和温度T的关系如下表所示:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:[CO2]·[H2]=[CO]·[H2O],试判断此时的温度为__℃;
(5)830℃充入等体积的CO2 和H2 达到平衡后CO2 的转化率为___;
Ⅲ.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下__(填“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,该反应在低温下__(填“能”或“不能”)自发进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com