
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释 ④KClO3分解制O2⑤生石灰跟水反应生成熟石灰⑥石灰石高温分解⑦铝热反应⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O=CO+H2 ⑩Al与盐酸反应
A. ②③④⑥⑦⑧⑨ B. ②④⑥⑧⑨ C. ①②④⑥⑧ D. ②③④⑧⑨
【答案】B
【解析】
常见的吸热反应有多数分解反应、Ba(OH)2·8H2O与NH4Cl反应、C与H2O(g)、C与CO2的反应。
①液态水汽化,吸收热量,但属于物理变化,故①不符合题意;
②胆矾为CuSO4·5H2O,胆矾受热CuSO4·5H2O![]() CuSO4+5H2O,属于吸热反应,故②符合题意;
CuSO4+5H2O,属于吸热反应,故②符合题意;
③浓硫酸稀释属于放热过程,故③不符合题意;
④KClO3分解属于吸热反应,故④符合题意;
⑤生石灰与水反应是放热反应,故⑤不符合题意;
⑥石灰石高温分解,属于吸热过程,故⑥符合题意;
⑦铝热反应为放热反应,故⑦不符合题意;
⑧Ba(OH)2·8H2O与NH4Cl反应属于吸热反应,故⑧符合题意;
⑨C和H2O反应属于吸热反应,故⑨符合题意;
⑩Al与盐酸反应属于放热反应,故⑩不符合题意;
综上所述,选徐B符合题意。


科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X :______________ 沉淀A:______________ 沉淀B:________________。
(2)上述实验流程中加入过量的Na2CO3的目的是____________________________。
(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清远市某校的化学兴趣小组经常做探究实验:
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3-。回答下列问题:
(1)仪器a名称:____________。
(2)B瓶内装的物质是:_________。
(3)若NO能被Na2O2完全吸收,E装置中的现象为__________________。
(4)三颈烧瓶A中反应的化学方程式为______________________。
(5)C装置的作用是_________________________。
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)某同学测定部分变质的Na2SO3样品中Na2SO3的含量(已知在酸性条件下IO3-能将SO32-氧化为SO42-,自身还原为I-):
①用电子天平称取16.00gNa2SO3固体配成l00mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000mol/L酸性KIO3溶液(硫酸酸化)滴定,三次平行实验所用标准液体积的平均值为24.00mL。则滴定终点时锥形瓶中产生的现象______________,写出与产生终点现象有关反应的离子方程式__________,样品中Na2SO3的质量分数为_________。(计算结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、Ⅹ、Y、Z的原子序数依次增加,X的质子数是W与Z的质子数之和的一半。m、n、p是由这些元素组成的二元化合物,r是元素Y的气体单质,n为淡黄色粉末,相关物质转化关系如图所示。室温下,0.01mol/Ls溶液pH为12。下列说法正确的是

A. 原子半径大小:W<X<Y B. 简单离子半径大小:Y<Z
C. 简单氢化物沸点高低:Z<Y<X D. Y、Z形成的化合物均含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物有着重要用途。回答下列问题:
(1)基态碳原子的价层电子排布图为___________。
(2)在CH2=CHCN中,碳原子的杂化方式有___________、___________,所含σ键数目和π键数目之比为___________。
(3)甲烷、水、氨气中C、O、N原子均采用sp3杂化方式,VSEPR模型均为正四面体构型,比较三者键角的大小___________(由大到小,用H一R—H表示),其原因是___________。
(4)C60室温下为紫红色固体,不溶于水,能溶于四氯化碳等非极性溶剂。据此判断C60的晶体类型是___________。
(5)C60晶胞结构如图,C60分子处于顶点和面心。已知:C60晶胞棱长为14.20 (1=10-8cm),则C60的晶体密度为___________g/cm3。
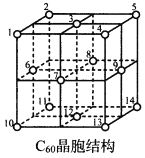
C60体中存在正四面体空隙(例如1、3、6、7四点构成)和正八面体空隙(例如3、6、7、8、9、12六点构成),则平均每一个C60晶胞中有___________个正四面体空隙和4个正八面体空隙。当碱金属元素全部占满所有空隙后,这类C60掺杂物才具有超导性。若用金属铯(Cs)填满所有空隙,距离最近的两个Cs原子间的距离为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸多巴酚丁胺治疗心力衰竭,尤其是慢性心力衰竭疗效好。合成路线如下

已知: ;
;

回答下列问题:
(1)A中含氧官能团的名称为___________。
(2)B的结构简式为___________,D的结构简式为___________。
(3)在反应①~④中,属于还原反应的有___________。
(4)A的同分异构种类很多,符合以下条件的A的同分异构共有___________种(不考虑立体异构)。
a.属于苯的衍生物; b.能水解,且水解产物之一能发生银镜反应
(5)反应①除A与B反应生成C外,B与B还可能发生反应生成另一种化合物E,写出生成E的反应的化学方程式___________。
(6)C在核磁共振氢谱上有___________组峰。
(7)写出由甲醛和乙醛合成季戊四醇[C(CH2OH)4]的合成路线。___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组研究了其他条件不变时,改变条件对可逆反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0的影响。下列说法正确的是
2SO3(g) ΔH<0的影响。下列说法正确的是

A. 图1研究的是温度、压强对平衡的影响,横轴表示压强
B. 图2研究的是温度对平衡的影响,Ⅱ采用的温度更低
C. 图3中t0时使用了催化剂,使平衡向正反应方向移动
D. 图4中t0时增大压强,使平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某双原子分子构成的气体,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA。对质量为m g的该气体,求:(用含M、NA、m符号的式子表示)。
(1)在标准状况下,该气体的体积为________L,密度为________g·L-1。
(2)该气体所含的原子总数为________个。
(3)该气体的一个分子的质量约为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是

A. HC2O4-![]() H++C2O42- K=1×10-4.3
H++C2O42- K=1×10-4.3
B. 将10mL0.1mol/L的H2C2O4溶液与15mL0.1mol/L的NaOH溶液混合后,所得溶液pH等于4.3
C. 常温下HF的Ka=1×10-3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为H2C2O4+F-=HF+HC2O4-
D. 在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com