
����Ŀ����Զ��ijУ�Ļ�ѧ��ȤС�龭����̽��ʵ�飺
(һ)Ϊ��̽��һ�������ܷ�Na2O2��ȫ���գ����������ʵ�顣װ�����£�����װ��ʡ�ԣ���

����������֪����2NO+Na2O2=2NaNO2�������������£�NO��NO2������KMnO4��Һ��Ӧ����NO3-���ش��������⣺
(1)����a���ƣ�____________��
(2)Bƿ��װ�������ǣ�_________��
(3)��NO�ܱ�Na2O2��ȫ���գ�Eװ���е�����Ϊ__________________��
(4)������ƿA�з�Ӧ�Ļ�ѧ����ʽΪ______________________��
(5)Cװ�õ�������_________________________��
(��)ʵ���ҳ���Na2SO3������Ũ���ᷴӦ��ȡSO2
(6)ijͬѧ�ⶨ���ֱ��ʵ�Na2SO3��Ʒ��Na2SO3�ĺ�������֪������������IO3-�ܽ�SO32������ΪSO42-��������ԭΪI-����
���õ�����ƽ��ȡ16.00gNa2SO3�������l00mL��Һ��ȡ25.00mL����ƿ�У������뼸�ε�����Һ��
����0.1000mol/L����KIO3��Һ�������ữ���ζ�������ƽ��ʵ�����ñ�Һ�����ƽ��ֵΪ24.00mL����ζ��յ�ʱ��ƿ�в���������______________��д��������յ������йط�Ӧ�����ӷ���ʽ__________����Ʒ��Na2SO3����������Ϊ_________����������������λ��Ч���֣�
���𰸡���Һ©�� ˮ����H2O ���Ը��������Һ����ɫ������Һ��ɫ����ȥ C+4HNO3(Ũ)![]() CO2��+4NO2��+2H2O ����NO����ȥ������̼(���ȥˮ��CO2) ��Һ(����ɫ)�������Ұ�����ڲ���ɫ 6H++5I-+IO3-=I2+3H2O 22.68%
CO2��+4NO2��+2H2O ����NO����ȥ������̼(���ȥˮ��CO2) ��Һ(����ɫ)�������Ұ�����ڲ���ɫ 6H++5I-+IO3-=I2+3H2O 22.68%
��������
(һ)װ��A����Ũ�����̼���ȷ�Ӧ����NO2��CO2��ˮ��װ��B��NO2ת��ΪNO������ʢ��ˮ��װ��C�еļ�ʯ�Ҹ���NO�������ճ�ȥCO2����NO����ȫ���գ������Ը��������Һ��ɫ����ȥ�������Ը��������Һ���Գ�ȥβ����NO����ֹ��Ⱦ������
(��)����KIO3��Һ�ζ������������Ʒ���������ԭ��Ӧ���ɵ����ӣ����������������ȫ��Ӧ���ٵ����������ӷ���������ԭ��Ӧ���ɵⵥ�ʣ������۱��������ݹ�ϵʽKIO3��3Na2SO3���㡣
(һ)װ��A����Ũ�����̼���ȷ�Ӧ����NO2��CO2��ˮ��װ��B��NO2ת��ΪNO������ʢ��ˮ��װ��C�еļ�ʯ�Ҹ���NO�������ճ�ȥCO2����NO����ȫ���գ������Ը��������Һ��ɫ����ȥ�������Ը��������Һ���Գ�ȥβ����NO����ֹ��Ⱦ������
(1)�������Ľṹ��֪������a����Ϊ��Һ©����
(2)Bƿ��Һ����NO2��Ӧ����NO����Һ�����ʿ�����ˮ����ѧʽΪH2O��
(3)��NO�ܱ�Na2O2��ȫ���գ�Eװ���е�����Ϊ�����Ը��������Һ��ɫ���仯����ɫ��
(4)������ƿA�з�Ӧ�Ļ�ѧ����ʽΪ��C+4HNO3(Ũ)![]() CO2��+4NO2��+2H2O
CO2��+4NO2��+2H2O
(5)Cװ��ʢ�м�ʯ�ң��������ǣ�����CO2��ˮ������
(��)(6)����KIO3��Һ�ζ������������Ʒ���������ԭ��Ӧ���ɵ����ӣ����������������ȫ��Ӧ���ٵ����������ӷ���������ԭ��Ӧ���ɵⵥ�ʣ������۱�������ζ��յ�ʱ��ƿ�в���������Ϊ�����������һ������KIO3��Һʱ����Һ�������Ұ�����ڲ���ɫ�������յ������йط�Ӧ�����ӷ���ʽ��6H++5I-+IO3-=I2+3H2O��25mL��Һ���ĵ���ص����ʵ���Ϊ0.1��24��10-3mol����KIO3��3Na2SO3����֪25mL��Һ��Na2SO3���ʵ���Ϊ0.1��24��10-3mol��3����16.00g��Ʒ��Na2SO3���ʵ���Ϊ0.1��24��10-3mol��3��![]() ����Ʒ��Na2SO3����������Ϊ[(0.1��24��10-3mol��3��
����Ʒ��Na2SO3����������Ϊ[(0.1��24��10-3mol��3��![]() ��126g/mol)��16.00g]��100%=22.68%��
��126g/mol)��16.00g]��100%=22.68%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��λ�ڲ�ͬ��������ֶ�����Ԫ�ؼס��ҡ�����������ԭ����������������ԭ�Ӱ뾶r(��) > r(��) > r(��) > r(��)������Ԫ���У�ֻ��һ��Ϊ����Ԫ�أ��Һͱ�ԭ�ӵ�����������֮��Ϊ��ԭ�ӵ�������������3�����ݴ��ƶϣ�������ȷ����
A. ���ļ��⻯������ڴ������
B. �ɼס�����Ԫ����ɵĻ������У�ֻ���м��Լ�
C. �ɼͱ���Ԫ����ɵķ��Ӳ�ֹһ��
D. �ҺͶ���Ԫ�ص�����������ˮ����֮���ܷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2O2��H2SO4�Ļ����Һ���ܳ�ӡˢ��·���е�ͭ�����Ȼ�ѧ����ʽΪCu(s)��H2O2(l)��2H��(aq)===Cu2��(aq)��2H2O(l)����H��֪��Cu(s)��2H��(aq)===Cu2��(aq)��H2(g)�� ��H1����64 kJ��mol��1��2H2O2(l)===2H2O(l)��O2(g)�� ��H2����196 kJ��mol��1��H2(g)��1/2O2(g)===H2O(l)�� ��H3����286kJ��mol��1������˵������ȷ����
A. ��Ӧ�ٿ�ͨ��ͭ���缫���ϡH2SO4�ķ���ʵ��
B. ��Ӧ�����κ������¶����Է�����
C. ��H2(g)+1/2O2(g)===H2O(g)����H4������H4<��H3
D. ��H����320 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmX(g) +nY(g) ![]() pZ(g) �ڲ�ͬ�¶ȣ�T1��T2����ѹǿ��P1��P2���£�����Z�����ʵ�����nZ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����
pZ(g) �ڲ�ͬ�¶ȣ�T1��T2����ѹǿ��P1��P2���£�����Z�����ʵ�����nZ���뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ�������ж���ȷ����

A. T1<T2 ��P1>P2
B. T1<T2 ��m+n��p
C. m+n��p ������Ӧ����
D. P1��P2������Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1911�꣬¬ɪ������![]() ����ɢ��ʵ���������
����ɢ��ʵ���������
A.����ԭ����B.ԭ�ӽṹ�����Ѹ����ģ��
C.ԭ�ӽṹ������ģ��D.��������Ų�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
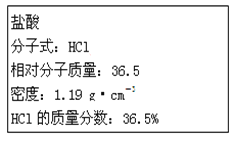
��1����Ũ������HCl�����ʵ���Ũ��Ϊ____mol��L-1��
��2��ȡ����������ĸ�������Һʱ�������������в�����ȡ����Ķ��ٶ��仯����___
A.��Һ��HCl�����ʵ��� B.��Һ��Ũ��
C.��Һ���ܶ� D.��Һ��Cl-����Ŀ
��3����������ƿ��ʹ�÷����У�����ȷ����____
A.ʹ������ƿǰ�����Ƿ�©ˮ
B.����ƿ��ˮϴ�������ô�����Һϴ��
C.������Һʱ����������ǹ��壬�ѳƺõĹ�����ֽ��С�ĵ�������ƿ�У�������ˮ����̶���1��2cm�����ý�ͷ�ιܼ�����ˮ���̶��ߡ�
D.������Һʱ����������Һ�壬����Ͳȡ�����ò�����������������ƿ�У�������ˮ����̶���1��2cm�����ý�ͷ�ιܼ�����ˮ���̶��ߡ�
E.�Ǻ�ƿ������ʳָ��סƿ������һֻ����סƿ�ף�������ƿ������ת��Σ�ҡ�ȡ�
��4��ijѧ����������Ũ���������ˮ����480mL���ʵ���Ũ��Ϊ0.200 mol��L-1��ϡ���ᡣ
�����貣���������ձ�����Ͳ������������ͷ�ι����_____��
�ڸ�ѧ����Ҫ����Ͳ��ȡ___mL����Ũ����������ơ������ƹ����У�����ʵ�������ʹ�����Ƶ�ϡ��������ʵ���Ũ��ƫ�����____
A.ת����Һ��δϴ���ձ��Ͳ�������ֱ�Ӷ���
B.����Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��
C.������ƿ�ж���ʱ���ӿ̶���
D.���ݺ������ƿ����ҡ�ȣ�����Һ����ڿ̶��ߣ��ּ�ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�к�ˮ��������Ӧ����ˮ�����з�����ԭ������ȫ�����е��ǣ� ��
A. ����������ʹ��ˮ���ηֳ���������
B. ����̫���ܣ�����ˮ����
C. ���ð�Ĥ�����÷�������ʹ��ˮ����
D. ����ˮͨ�����ӽ�����֬���Գ�ȥ�������η�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У��������ȷ�Ӧ����( )
��Һ̬ˮ�����ڽ��������ȱ�Ϊ��ɫ��ĩ��ŨH2SO4ϡ�� ��KClO3�ֽ���O2����ʯ�Ҹ�ˮ��Ӧ������ʯ�Ң�ʯ��ʯ���·ֽ�����ȷ�Ӧ��Ba(OH)2��8H2O�����NH4Cl��Ϣ�C��H2O=CO��H2 ��Al�����ᷴӦ
A. �ڢۢܢޢߢ�� B. �ڢܢޢ�� C. �٢ڢܢޢ� D. �ڢۢܢ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ���ӣ��ֱ�ȡ����
���ӣ��ֱ�ȡ����![]() �����Һ�������ԣ�
�����Һ�������ԣ�![]() �����������ᣬ����ɫ��ζ���������Ϊȷ����Һ��ɣ�����Ҫ����������
�����������ᣬ����ɫ��ζ���������Ϊȷ����Һ��ɣ�����Ҫ����������![]() ����
����![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com