
科目: 来源: 题型:
【题目】量取8.0mL 5.0 molL-1 H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。下列说法正确的是
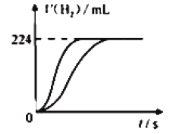
A.稀释后H2SO4溶液的物质的量浓度为0.04 molL-1
B.加入Fe的质量至少有0.56 g
C.反应过程中铁粉过量
D.金属Zn与硫酸反应转移电子数为0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
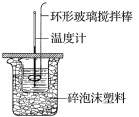
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是___(填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___。
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=___(结果保留一位小数)。
(4)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图配制450mL1.00 mol·L-1 NaOH溶液的示意图,下列说法正确的是

A.图①中应称得NaOH 18.0 g
B.未进行④和⑤的操作,所配溶液浓度将偏大
C.定容后把容量瓶倒置摇匀,发现液面低于刻度线不必再加水至刻度线
D.步骤②后应将溶液立即转移到容量瓶中,防止药品变质
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
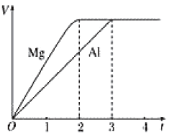
A.二者物质的量之比为3:2
B.二者质量之比为2:3
C.二者分别与足量的氢氧化钠溶液,产生气体体积仍然相等
D.二者消耗H2SO4的物质的量之比为2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+![]() S↓+2I2+2H2O ii.I2+2H2O+SO2
S↓+2I2+2H2O ii.I2+2H2O+SO2![]() SO42- +4H++2I-
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
下列说法不正确的是( )
A. 水溶液中SO2歧化反应方程式为3SO2+2H2O ![]() 2H2SO4 +S↓
2H2SO4 +S↓
B. II是I的对比实验,则a=0.4
C. 比较I、II、III,可得出的结论是:I是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D. 实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. N2(g)转化为氮原子是一个放热过程
B. 1mol N2和lmol O2的总能量比2molNO的总能量高
C. 1个NO(g)分子中的化学键断裂时需要吸收632kJ能量
D. 2NO(g)=N2(g)+O2(g)的反应热△H=-180 kJ/ mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:___;
(2)该反应的正反应为__反应(“吸热”或“放热”);
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是__(填代号)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=1的两种酸溶液HA、HB各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
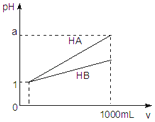
A.同浓度、同体积的HA、HB溶液分别加入过量的锌粒,产生的氢气体积后者大
B.pH相同的HA、HB溶液,物质的量浓度HA<HB
C.若1<a<4,则HA、HB都是弱酸
D.体积相同pH均为1的HA、HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. ![]() 、
、![]() 为不同的核素,化学性质也不同
为不同的核素,化学性质也不同
B. 乙醇和乙醚互为同分异构体
C. CH3CH(CH3)2的名称叫2-甲基丙烷,也可以叫做异丁烷
D. CH2=CH2和CH2=CH-CH=CH2具有相同的官能团,互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com