
科目: 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图一:

已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6,密度为0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是___。
(2)步骤①中通入氮气的目的是___。
(3)仪器c的适宜容积应为(选编号):___。
①100mL ②250mL ③500mL
(4)步骤⑤用盐酸洗涤的目的是___。
(5)步骤⑦是二茂铁粗产品的提纯,该过程在图二中进行,其操作名称为___;该操作中棉花的作用是___。
(6)若最终制得纯净的二茂铁4.3g,则该实验的产率为___(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,某气态烷烃和烯烃(含一个双键)的混合气体2.24 L完全燃烧后,将产生的气体缓慢通过浓硫酸,浓硫酸增重4.05 g,剩余气体通过碱石灰,碱石灰增重6.60 g。另再取2.24 L标准状况下的该混合气体,将它通入过量的溴水中,溴水增重1.05 g。
(1)确定混合气体由哪两种烃组成_______。
(2)计算混合气体中两种烃的体积分数_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是重要的药物中间体,合成路线如下:
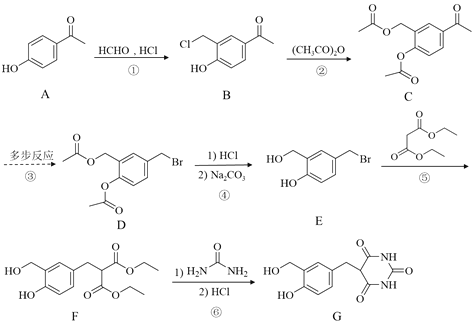
回答下列问题:
(1)A的分子式为_________。
(2)B中含氧官能团的名称为_________。
(3)D→E的反应类型为_________。
(4)已知B与(CH3CO)2O的反应比例为1:2,B→C的反应方程式为_________。
(5)路线中②④的目的是_________。
(6)满足下列条件的B的同分异构体有_________种(不考虑立体异构)。
①苯环上只有2个取代基
②能与FeCl3溶液发生显色反应且能发生银镜反应
写出其中核磁共振氢谱为五组峰的物质的结构简式为_________。
(7)参考上述合成线路,写出以1-溴丁烷、丙二酸二乙酯、尿素[CO(NH2)2]为起始原料制备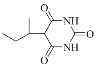 的合成线路(其它试剂任选)_________。
的合成线路(其它试剂任选)_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.用惰性电极电解 Na2SO4 溶液,当 2 mol 电子转移时,可加入 18 g 水恢复
B.用惰性电极电解 1 L 1 mol/L CuSO4 溶液,当加入 1 mol Cu(OH)2 恢复电解前浓度时, 电路中转移了 4 mol e-
C.用惰性电极电解 1 mol CuSO4 和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大
D.要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期元素Q位于ds区,最外层电子半充满;短周期元素W、X、Y、Z第一电离能与原子序数的关系如下图所示,请回答下列问题(用Q、W、X、Y、Z所对应的元素符号作答):

(1)基态Y原子核外共有___种运动状态不相同的电子。若用n表示能层,则与Y元素同族的元素的基态原子的价电子排布式为_________________。
(2)X、W组成的一种二元化合物常用作火箭燃料,该化合物中X原子的杂化方式为___________。该化合物常温下呈液态,其沸点高于Y2沸点的原因为___________。
(3)X2Y曾被用作麻醉剂,根据“等电子体原理”预测X2Y的空间构型为______________。
(4)XW3存在孤电子对,可形成[Q(XW3)4]2+离子,该离子中不存在_____________(填序号)。
A.极性共价键 B.非极性共价键 C.配位键 D.σ键 E.π键
(5)Q与X形成的一种二元化合物的立方晶胞结构如图所示:
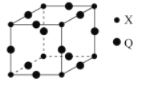
①Q原子周围距其距离最近的Q原子的数目为_______。
②该二元化合物的化学式为___________________。
(6)已知单质Q晶体的堆积方式为面心立方最密堆积,则单质Q晶体的晶胞中原子的空间利用率为_________________(用含π的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向10mL 0.1![]()
![]() 溶液中滴加0.1
溶液中滴加0.1![]()
![]() 溶液,滴加过程中溶液中
溶液,滴加过程中溶液中![]() 与
与![]() 溶液体积(V)的变化关系如图所示,下列有关说法正确的是[已知:
溶液体积(V)的变化关系如图所示,下列有关说法正确的是[已知: ![]() ]( )
]( )
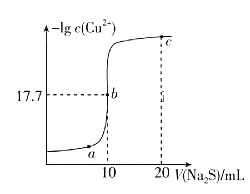
A.a、b、c三点中,水的电离程度最大的为b点
B.![]() 溶液中:
溶液中:![]()
C.该温度下![]()
D.向100mL ![]() 、
、![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
![]()
下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能燃烧,其产物一定为二氧化碳和水
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃下,弱电解质的电离平衡常数![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.用0.1mol/L的盐酸滴定0.1mol/L的氨水时,可用酚酞作指示剂
B.0.2mol/L的醋酸与0.1mol/L的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中![]()
D.pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:

①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com