
科目: 来源: 题型:
【题目】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;②Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-。
回答下列问题:
Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:
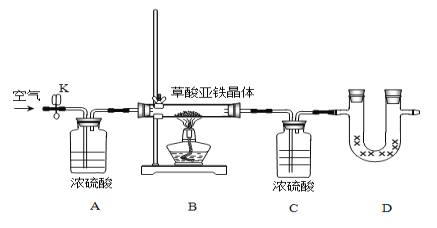
①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为____________________,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入空气 e.冷却至室温 f.称量
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式_____________________
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有__________
(3)x=_______________
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列变化进行推断:
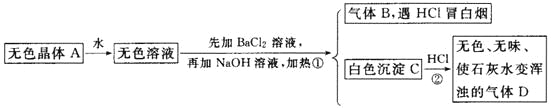
且已知对A加强热产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①________________________________________________________________;
②________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
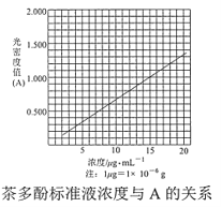
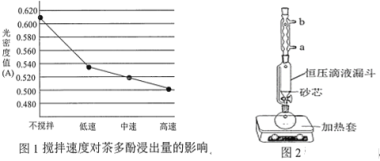
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将Fe3+还原为Fe2+,Fe2+与K3Fe(CN)6生成的深蓝色配位化合物KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
某实验小组设计如下实验流程从茶叶中提取茶多酚:
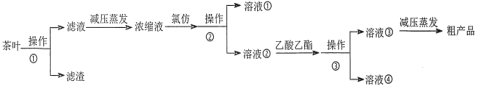
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图1所示,原因是_____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入________________中,圆底烧瓶内加___________和适量乙醇,如图2安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是_________。
(2)减压蒸发相对于一般蒸发的优点是_____________;氯仿的作用是_________________。
(3)下列有关实验基本操作不正确的是____________。
A.图2中冷凝水流向为a进b出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和_______酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是______(以质量分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.若升高温度,W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是 K= ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,氯元素的原子核外有____种不同运动状态的电子;有___种不同能级的电子,基态Fe3+的电子排布式为___。
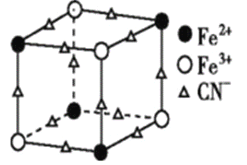
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是____;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如图所示(K+未画出),则一个晶胞中的K+个数为 ___。
结构如图所示(K+未画出),则一个晶胞中的K+个数为 ___。
(3)Cu2+能与乙二胺(H2N-CH2-CH2-NH2)形成配离子。该配离子中含有的化学键类型有 __ (填字母)
a.配位键 b.极性键 c.离子键 d.非极性键,
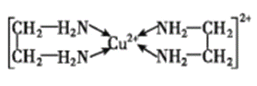
乙二胺中共有____个σ键,C原子的杂化方式为 ___。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3,则铜原子的直径约为____pm。
(5)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。回答下列问题。某化合物的化学式为Na3CrO8,其阴离子结构可表示为![]() ,则Cr的化合价为____。CrO42-呈四面体构型,结构为
,则Cr的化合价为____。CrO42-呈四面体构型,结构为![]() ,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为
,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为![]() 。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为____。
。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反应N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
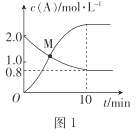
①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_______。
②M点时,N2H4的转化率为______(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡______(填“正向移动”“逆向移动”或“不移动”)。
(3)①在惰性气体中,将黄磷(P4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH2PO2,同时还产生磷化氢(PH3)气体,该反应的化学方程式为________________。
②次磷酸(H3PO2)是一元酸,常温下.1.0 mol●L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=___________。
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于____(填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为______,当电路中流过3.8528×105库仑电量时.制得次磷酸的物质的量为_____ (一个电子的电量为 1.6×10- 19库仑,NA数值约为6. 02× 1023)。
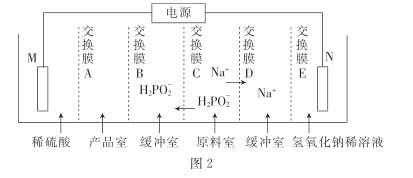
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com