
科目: 来源: 题型:
【题目】W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法正确的是( )
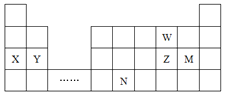
A.原子半径:![]() 简单离子半径:
简单离子半径:![]()
B.单质的还原性:![]() 简单氢化物的沸点:
简单氢化物的沸点:![]()
C.溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D.元素N位于金属与非金属的分界线附近,可以推断N的单质可作半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。锂离子电池广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜中主要含有钴酸锂(LiCoO2)、Al等,处理该废料的一种工艺如下图所示:

回答下列问题:
(1)铝钴膜在处理前初步进行粉碎的目的是________________________。
(2)能够提高“碱浸”效率的方法有________________________(至少写两种)。
(3)“碱浸”时Al溶解的离子方程式为________________________。
(4)“酸溶”时加入H2O2的目的是________________________。
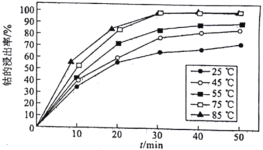
(5)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是_______________________。
(6)配制250 mL 1.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外还需要________。
(7)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该钴的氧化物的化学式为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g)![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
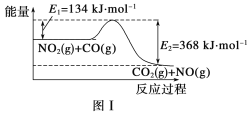

下列有关说法正确的是( )
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目: 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目: 来源: 题型:
【题目】在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,曲线如图所示,有关粒子的浓度关系正确的是
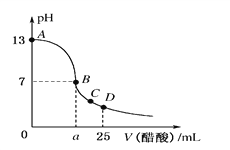
A. 在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)> c(H+) >c(OH-)
B. 在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. 在C点:c(CH3COO-)>c(Na+)> c(OH-) > c(H+)
D. 在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是( )
A | B | C | ||
D | ||||
A.原子半径大小比较为D>C>B>A
B.生成的氢化物分子间均可形成氢键
C.A与C形成的阴离子可能有AC![]() 、A2C
、A2C![]()
D.A、B、C、D的单质常温下均不导电
查看答案和解析>>
科目: 来源: 题型:
【题目】在一体积不变的密闭容器中发生化学反应:Fe2O3(s)+2NH3(g)![]() 2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )
2Fe(s)+N2(g)+3H2O(g) △H,实验测得化学平衡时的有关变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。下列说法不正确的是( )

A.NH3是正反应的还原剂
B.气体压强P2>P1
C.平衡后再充入一定量NH3,则平衡左移,NH3的体积分数减小
D.M点的平衡常数Kp=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】塑料、橡胶等材料的交联剂F的合成路线如图所示:

已知:
回答下列问题:
(1)芳香族化合物A中官能团的名称为________________。
(2)C→D的反应类型是_______________,E的结构简式为________________。
(3)F与NaOH反应的化学方程式为___________________________________。
(4)F的同分异构体中符合下列条件的有______________(不考虑立体异构)种。
a.属于![]() 的二取代物
的二取代物
b.取代基处于对位且完全相同
c.含酯基且能发生银镜反应
其中核磁共振氢谱有4组峰,峰面积之比为6:2:1:1的结构简式为__________________(写出一种)。
(5)参照题干中合成路线,设计以丙酮为主要原料制备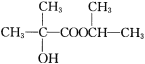 的合成路线(无机试剂任选)。________________________
的合成路线(无机试剂任选)。________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染问题中有着重要的作用。
(1)已知:①2CO(g)+O2(g)=2CO2(g)△H1=-566.0kJ·mol-1
②N2(g)+2O2(g)=2NO2(g)△H2=+64kJ·mol-1
反应2NO2(g)+4CO(g=N2(g)+4CO2(g)在__________(填“高温”或“低温”)条件下能自发进行。
(2)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1:2、1:1.5、3:1时,NO脱除率随温度变化的曲线如图1所示。

①曲线a中,NO的起始浓度为6×10-4mg·m-3,若从X点到Y点经过20s,则该时间段内NO的脱除速率为_________mg·m-3·s-1。
②曲线c对应的NH3与NO的物质的量之比是________,其理由是__________
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程中的能量变化模拟计算结果如图2所示。无水情况下,一个氧分子的活化能为__________,容易活化氧分子的条件是_________(填“有水”或“无水”)。
(4)若反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的正、逆反应速率分别可表示为v正=k正c2(NO)·c2(CO);v逆=k逆c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molNO和4molCO发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图3所示。
N2(g)+2CO2(g)的正、逆反应速率分别可表示为v正=k正c2(NO)·c2(CO);v逆=k逆c(N2)·c2(CO2),k正、k逆分别为正、逆反应速率常数,c为物质的量浓度。一定温度下,在体积为1L的恒容密闭容器中加入4molNO和4molCO发生上述反应,测得CO和CO2的物质的量浓度随时间的变化如图3所示。

①a点时,v逆:v正=_____________。
②测得平衡时体系压强为p,KP为用气体分压表示的平衡常数,分压=总压×物质的量分数,则平衡常数KP=____________(用含p的式子表示)。
(5)某研究小组探究该反应中催化剂对脱氮率(NO的转化率)的影响。将等物质的量的NO和CO以一定的流速分别通过催化剂a、b,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图4中曲线Ⅰ所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图4中画出使用催化剂b时所对应的曲线(从300℃开始画)。_______________
N2(g)+2CO2(g)。相同时间、不同温度下测得使用催化剂a时脱氮率与温度的关系如图4中曲线Ⅰ所示。已知催化效率b>a,催化剂b的活性在450℃时最大(未达平衡)。请在图4中画出使用催化剂b时所对应的曲线(从300℃开始画)。_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】六氟合铝酸钠(Na3AlF6)俗称冰晶石,微溶于水,可用作陶瓷乳白剂、树脂橡胶的耐磨填充剂等。实验室以萤石(CaF2,难溶于水)、石英和纯碱等为原料可制备Na3AlF6,实验步骤如下:
Ⅰ.将萤石(CaF2)、石英和纯碱按一定比例混合后煅烧并释放出CO2;
Ⅱ.……
Ⅲ.在浸取液中加入稀硫酸调节pH,再加入硫酸铝,充分反应后过滤,洗涤烘干后得到六氟合铝酸钠。
回答下列问题:
(1)Na3AlF6中铝元素的化合价为__________。
(2)步骤Ⅰ中煅烧原料混合物时,盛装原料混合物的仪器名称为___________;混合物煅烧后除生成CO2、CaSiO3外还有一种产物(二元化合物),该物质的化学式为______________。
(3)步骤Ⅱ的具体内容是__________________。
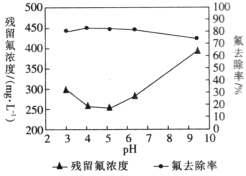
(4)通过实验探究不同pH时氟离子的去除率,即对多份相同量的浸取液调节至不同pH后,再分别加入等量硫酸铝,得到了溶液中残留氟浓度和氟去除率随溶液pH的变化关系如图所示。则步骤Ⅲ中最佳pH为_________;图中当pH增大时,氟去除率下降的原因是_______________________________________。
(5)步骤Ⅲ中检验过滤后的固体已洗涤干净的方法是_______________________________。
(6)写出一种能将含氟废水中氟离子去除的可行方法:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com