
科目: 来源: 题型:
【题目】磷及其化合物在工农业生产中有重要的作用。
(1)P元素有白磷、红磷、黑磷三种常见的单质。
①现代化学中,常利用_______上的特征谱线来鉴定元素。
②白磷(P4)易溶于CS2,难溶于水,原因是_________。
③黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体具有与石墨相类似的层状结构,如下图所示。下列有关黑磷晶体的说法不正确的是_______。
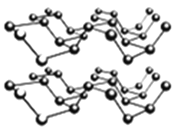
A.黑磷晶体中磷原子杂化方式为sp3杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(2)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化磷和三溴化硼于高温下在氢气中反应合成。磷化硼晶体的晶胞如下图所示,其中实心球为磷原子。
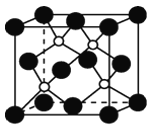
请回答下列问题:
①磷化硼的化学式为_________,该晶体的晶体类型是___________。
②三溴化磷中溴元素基态原子的电子排布式为_________,三溴化硼分子的空间构型是________,合成磷化硼的化学方程式为:___________。
③在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为________,该结构中有一个配位键,提供空轨道的原子是_______。已知晶体中B与P原子的最近距离为a nm,则该晶体的密度的表达式为(不需化简)________g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用PCl5作为制造乙酰纤维素的催化剂,也常用于手性药品的研发,在材料,医药工业得到了广泛应用,请回答下列问题:
(1)PCl5在固态是离子化合物,相对式量为417,其阳离子为![]() ,则阴离子的化学式为_______。
,则阴离子的化学式为_______。
(2)已知: P(s) + ![]() Cl2(g) = PCl3(g) H= -306 KJ/mol
Cl2(g) = PCl3(g) H= -306 KJ/mol
PCl5(g) = PCl3(g) + Cl2(g) H= + 93 KJ/mol
则反应2P(s) + 5Cl2(g) = 2PCl5(g)的H=______kJ/mol。
(3)温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,容器中发生反应:PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 0 | 0.12 | 0.17 | 0.2 | 0.2 |
①反应在前10min的平均速率v(PCl5)=_______;
②不能表明该反应达到平衡状态的是:____ (选填序号);
a.容器的总压强不再改变
b.混合气体的平均相对分子质量不变
c.v正(PCl3)等于v逆(Cl2)
d.混合气体的密度不变
e.PCl5的质量不再变化
③要提高上述反应的转化率,可采取的措施有(至少两种)___________;
④该温度下,反应PCl5(g)PCl3(g) + Cl2(g)的平衡常数Kp=2.25×105(Kp为压强平衡常数,Kp=![]() )。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
)。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
(4)在热水中,五氯化磷完全水解,生成磷酸和盐酸。若将0.01molPCl5投入热水中配成lL溶液,再逐滴加入AgNO3溶液,先产生的沉淀是_____。 [已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
查看答案和解析>>
科目: 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
![]()
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
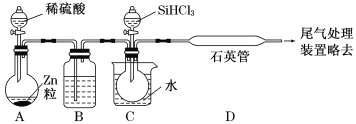
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠可用于照相业作定影剂、纸浆漂白作脱氯剂等。实验室用SO2通入Na2S和Na2CO3的混合液中来制备硫代硫酸钠。
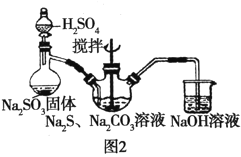
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S9H2O晶体。
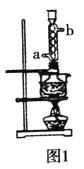
(1)下列说法不正确的是___。
A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用冷水淋洗
B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸
C.洗涤时,可用一定浓度的乙醇溶液洗涤晶体,目的是洗除晶体表面的杂质,易于得到干燥晶体
D.为加快产品的干燥,可高温烘干
E.在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是________,三颈烧瓶中发生反应的化学方程式__________。
(3)硫代硫酸钠样品中Na2S2O35H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol/L碘的标准溶液进行滴定。请回答:
①达到滴定终点的标志是_______。
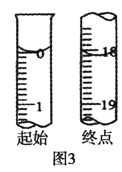
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为_______ mL,产品纯度为________(设Na2S2O35H2O相对分子质量为M)。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的纯度的测量结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有浓度均为1 mol/L的FeCl3、CuCl2的混合溶液100 mL,向该溶液中加入5.6 g铁粉充分反应(溶液的体积变化忽略不计)。已知,氧化性Fe3+> Cu2+下列有关叙述正确的是( )
A.反应后的溶液中n(Fe2+)是0.15 molB.反应后的溶液中不存在Fe3+和Cu2+
C.反应后残留固体为3.2 gD.反应后残留固体中可能含有未反应的铁粉
查看答案和解析>>
科目: 来源: 题型:
【题目】硒(Se)、碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于硒、碲及其化合物的叙述不正确的是_______。
A.Te 位于周期表的第五周期 Ⅵ A 族
B.Se 的氧化物通常有SeO2和SeO3
C.H2TeO4的酸性比H2SO4的酸性强
D.热稳定性H2Se比H2S弱,但比HBr强
(2)25℃ 时,硒酸的电离H2SeO4=H+ +![]() ;
;![]() H+ +
H+ +![]() Ka2 = 1×10-3,则0.1 mol·L-1NaHSeO4溶液的pH约为________;NaHSeO4溶液中的物料守恒表达式为____________。
Ka2 = 1×10-3,则0.1 mol·L-1NaHSeO4溶液的pH约为________;NaHSeO4溶液中的物料守恒表达式为____________。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含TeO2,还含有少量Ag、Au)为原料制备单质碲,其工艺流程如图:
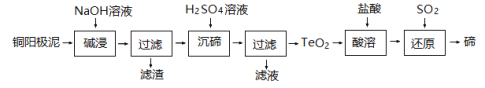
①铜阳极泥在碱浸前需烘干、研成粉末,目的是____________;
②“碱浸”时TeO2发生反应的化学方程式为_____________;
③“沉碲”时控制溶液的 pH 为 4.5~5.0,生成TeO2沉淀,酸性不能过强的原因是__________;
④“还原”得到固态碲为粗碲,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】星型聚合物SPLA可经下列反应路线得到(部分反应条件未注明)。

已知:SPLA的结构简式为: ,其中R为
,其中R为 。
。
(1)淀粉是___糖(填“单”或“多”);A的名称是___。
(2)生成D的化学反应类型属于___反应;D结构中有3个相同的基团,且1 mol D能与2 mol Ag(NH3)2OH溶液反应,则D的结构简式是___;D→E反应的化学方程式为___。
(3)B的直链同分异构体G的分子中不含甲基,G既不能与NaHCO3溶液反应,又不能与新制Cu(OH)2悬浊液反应,且1mol G与足量Na反应生成1 mol H2,则G的结构简式为___。
(4)B有多种脱水产物,其中两种产物的结构简式为______和______。
查看答案和解析>>
科目: 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数。常温下,一定浓度的某酸(H2A)的水溶液中pC(H2A)、pC(HA-)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是( )

A.pH=3时,c(H2A)=c(A2-)>c(HA-)
B.c(H2A)+c(HA-)+c(A2-)是定值
C.HA-的水解平衡常数为10-12.7
D.任何时候,溶液中都存在:c(H+)=c(OH-)+c(HA-)+2c(A2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为( )
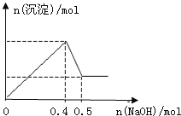
A.4∶3B.1∶3C.1∶4D.2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图 1,电池的工作原理如下图 2。下列有关说法正确的是

A.放电时,纸张中的石墨作锂电池的正极
B.开关 K 闭合给锂电池充电,金属锂电极上发生氧化反应
C.充电时,空气电极的反应式为: Li2O2 +2e- = 2Li+O2↑
D.电池工作时,电子的流向为:金属锂电极→有机电解质溶液→空气电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com