
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l)+Q(Q﹥0),若反应在恒容密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l)+Q(Q﹥0),若反应在恒容密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其它条件不变,分离出硫,正反应速率加快
C.达到平衡时,SO2、CO、CO2的平衡浓度一定为1:2:2
D.平衡时,其他条件不变,升高温度SO2的转化率降低
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为铜与稀硝酸反应的有关性质实验(洗耳球:一种橡胶为材质的工具仪器,可挤压)。
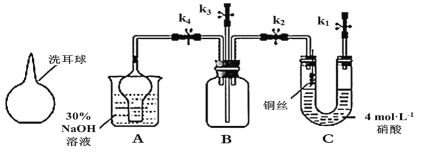
实验步骤如下:
①按照如图装置连接好仪器,关闭所有止水夹。检查装置的气密性。
②在装置A中的烧杯中加入30%的氢氧化钠溶液。在装置C的U型管中加入4.0mol·L-1的硝酸,排除U型管左端管内空气。
③塞紧连接铜丝的胶塞,打开止水夹K1,反应进行一段时间。
④进行适当的操作,使装置C中产生的气体进入装置B的广口瓶中,气体变为红棕色。气体进入烧杯中与氢氧化钠溶液反应。
回答下列问题:
(1)装置C中发生反应的离子方程式为__。反应后的溶液呈蓝色,其原因是铜离子和水分子形成了水合铜离子,1mol水合铜离子中含有σ键数目为12NA,该水合铜离子的化学式为__。
(2)装置A上面的导管口末端也可以连接__来代替干燥管,实现同样作用。
(3)加入稀硝酸,排除U型管左端管内空气的操作是__。
(4)步骤④中“使装置C中产生的气体进入装置B的广口瓶中”的操作是打开止水夹__(填写序号),并用洗耳球在U型管右端导管口挤压空气进入。
(5)步骤④中使“气体进入烧杯中与氢氧化钠溶液反应”的操作是__,尾气中主要含有NO2和空气,与NaOH溶液反应只生成一种盐,则离子方程式为有__。
(6)某同学发现,本实验结束后硝酸还有很多剩余,请你改进实验,使能达到预期实验目的,反应结束后硝酸的剩余量尽可能较少,你的改进是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g)![]() 2NO2(g)的基元反应如下(E为活化能):
2NO2(g)的基元反应如下(E为活化能):
2NO(g)![]() N2O2(g) E1=82kJ·mol-1 v=k1c2(NO)
N2O2(g) E1=82kJ·mol-1 v=k1c2(NO)
N2O2(g)![]() 2NO(g) E-1=205kJ·mol-1 v=k-1c(N2O2)
2NO(g) E-1=205kJ·mol-1 v=k-1c(N2O2)
N2O2(g)+O2(g)![]() 2NO2(g) E2=82kJ·mol-1 v=k2 c(N2O2)·c(O2)
2NO2(g) E2=82kJ·mol-1 v=k2 c(N2O2)·c(O2)
2NO2(g)![]() N2O2(g) + O2(g) E-2=72kJ·mol-1 v=k-2 c2(NO2)
N2O2(g) + O2(g) E-2=72kJ·mol-1 v=k-2 c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g) H=__kJ·mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=__;
2NO2(g) H=__kJ·mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=__;
②某温度下反应2NO(g) +O2(g)![]() 2NO2(g)的速率常数k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率是__mol·L-1·s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的__倍。
2NO2(g)的速率常数k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率是__mol·L-1·s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的__倍。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2→2VO2+SO3(快) 4VO2+O2→2V2O5(慢)
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2→2VO2+SO3(快) 4VO2+O2→2V2O5(慢)
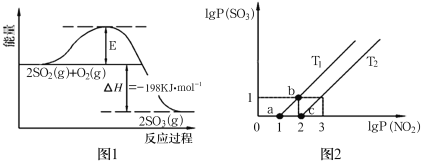
下列说法正确的是__(填序号)。
a.反应速率主要取决于V2O5的质量
b.VO2是该反应的催化剂
c.逆反应的活化能大于198kJ·mol-1
d.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g)![]() NO(g)+SO3(g) H<0中1gP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g) H<0中1gP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①T1__T2(填“>”“<”或者“=”),温度为T1时化学平衡常数Kp=__。
②由平衡状态a到b,改变的条件是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,浓度均为0.5 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的三种溶液,测得各溶液的c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A.a=b=cB.a>b>cC.a>c>bD.c>a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一,CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有___(填字母)。
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O![]() C6H12O6(葡萄糖)+6O2
C6H12O6(葡萄糖)+6O2
b.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
c.CO2+CH4![]() CH3COOH
CH3COOH
d.2CO2+6H2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是___,原子利用率最高的是___。
(3)为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施___。
a.减压、升温 b.增压、降温
c.减压、降温 d.增压、升温
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图(见下页):
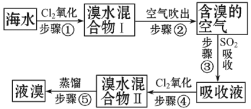
(1)步骤①反应的离子方程式是___。
(2)步骤③反应的化学方程式是___,从理论上考虑,下列也能吸收Br2的是___。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80℃~90℃。温度过高或过低都不利于生产,请解释原因:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为104,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是______________,与常规的萃取相比,采用索氏提取器的优点是______________。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收______________。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】快离子导体是一类具有优良离子导电能力的固体电解质。图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。回答下列问题:

(1)BF3+NH3=NH3·BF3的反应过程中,形成配位键时提供电子的原子是__,其提供的电子所在的轨道是__。
(2)基态Li+、B+分别失去一个电子时,需吸收更多能量的是__,理由是__。
(3)图1所示的晶体中,锂原子处于立方体的位置__。若其晶胞参数为apm,则晶胞密度为___g·cm-3(列出计算式即可)。
(4)氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中,则每一个空隙由__个Cl-构成,空隙的空间形状为___。
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的![]() ,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x,如图3)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Cl-)=185pm,![]() =1.4,
=1.4,![]() =1.7。
=1.7。
①x=__,y=__;(保留一位小数)
②迁移可能性更大的途径是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示。则下列对该反应的推断合理的是( )

A.该反应的化学方程式为6A+2D![]() 3B+4C
3B+4C
B.0~1s内, v(A)=v(B)
C.0~5s内,B的平均反应速率为006mol·L-1·s-1
D.5s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是

A.T℃时,该反应的化学平衡常数为![]()
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com