
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为104,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是______________,与常规的萃取相比,采用索氏提取器的优点是______________。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收______________。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
【答案】增加固液接触面积,提取充分 沸石 乙醇易挥发,易燃 使用溶剂少,可连续萃取(萃取效率高) 乙醇沸点低,易浓缩 AC 单宁酸 水 升华
【解析】
(1)萃取时将茶叶研细可以增加固液接触面积,从而使提取更充分;由于需要加热,为防止液体暴沸,加热前还要加入几粒沸石;
(2)由于乙醇易挥发,易燃烧,为防止温度过高使挥发出的乙醇燃烧,因此提取过程中不可选用明火直接加热;根据题干中的已知信息可判断与常规的萃取相比较,采用索式提取器的优点是使用溶剂量少,可连续萃取(萃取效率高);
(3)乙醇是有机溶剂,沸点低,因此与水相比较乙醇作为萃取剂的优点是乙醇沸点低,易浓缩;蒸馏浓缩时需要冷凝管,为防止液体残留在冷凝管中,应该选用直形冷凝管,而不需要球形冷凝管,A正确,B错误;为防止液体挥发,冷凝后得到的馏分需要有接收瓶接收馏分,而不需要烧杯,C正确,D错误,答案选AC。
(4)由于茶叶中还含有单宁酸,且单宁酸也易溶于水和乙醇,因此浓缩液中加入氧化钙的作用是中和单宁酸,同时也吸收水;
(5)根据已知信息可知咖啡因在100℃以上时开始升华,因此该分离提纯方法的名称是升华。


科目:高中化学 来源: 题型:
【题目】下列有关物质分类的说法中正确的是( )
A.现有![]() 、
、![]() 、
、![]() 、
、![]() ,可以按某个标准判断
,可以按某个标准判断![]() 与其他三种不同;也可按某个标准判断
与其他三种不同;也可按某个标准判断![]() 与其他三种不同
与其他三种不同
B.在物质分类时,一般是先分类,再定标准,这样就不会有误了
C.树状分类法是唯一能表示物质分类的方法
D.胶体、溶液、浊液分属不同类别的本质是其透过滤纸的性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法,不正确的是
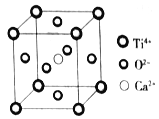
(Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)
A. 该晶体的化学式为CaTiO3
B. 该晶体中每个Ti4+和8个O2-相紧邻
C. 一个CO2晶胞中平均含有4个CO2分子
D. 金属晶体的熔点可能比分子晶体的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。
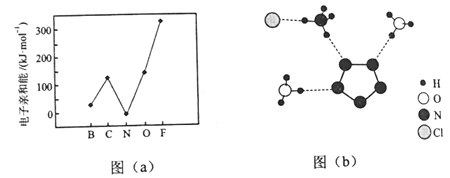
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置,将液体A逐滴加入到固体B中,下列叙述正确的是

A. 若A为H2O2,B为MnO2,C中Na2S溶液变浑浊
B. 若A为浓盐酸,B为MnO2,C中KI淀粉溶液变蓝色
C. 若A为浓氨水,B为生石灰,C中AlCl 3溶液先产生白色沉淀后 沉淀又溶解
D. 若A为浓盐酸 ,B为CaCO3,C中Na2SiO3 溶液出现白色沉淀,则非金属性C>Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将外观相近的钠、钾、镁、铝各1克分别投入到足量的同浓度的盐酸中,试预测实验结果:__与盐酸反应最剧烈,___与盐酸反应的速度最慢;__与盐酸反应产生的气体最多。
(2)向H2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律
(3)仪器A的名称为________
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____(填现象),即可证明
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_______溶液的洗气瓶除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用镁屑与液溴为原料制备无水MgBr2, 装置如图, 主要步骤如下:

步骤1组装好仪器,向三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2 。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁, 加热至160℃分解得无水Mg Br2产品。
已知:①Mg和Br2反应剧烈放热;Mg Br2具有强吸水性。
②MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5
③乙醚是重要有机溶剂,医用麻醉剂;易挥发储存于阴凉、通风处;易燃远离火源。
请回答下列问题:
(1)写出步骤2的操作是_________。
(2)仪器A的名称是__________。装置中碱石灰的作用__________。冰水浴的目的__________。
(3)该实验从安全角度考虑除了控制反应温度外,还需要注意:
①_________②_______。
(4)制备MgBr2装置中橡胶塞和用乳胶管连接的玻璃管口都要用锡箔纸包住的目的是_________。
(5)有关步骤4的说法,正确的是__________。
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度,可用EDTA(简写为Y4-) 标准溶液滴定,反应的离子方程式:Mg2+ +Y4-═MgY2-
①先称取0.7500g无水MgBr2产品,溶解后,等体积分装在3只锥形瓶中, 用0.0500mol·L-1的EDTA标准溶液滴定至终点,三次消耗EDTA标准溶液的体积平均为26.50mL, 则测得无水MgBr2产品的纯度是_______(保留4位有效数字)。
②滴定前未用标准溶液润洗滴定管,则测得产品纯度___________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com