
科目: 来源: 题型:
【题目】电化学降解治理水中硝酸盐的污染,在酸性条件下,电解的原理如图所示
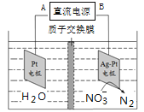
(1)A极为________极;
(2)阴极电极反应式为 _________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐。服用维生素C,有利于人体对铁元素的吸收。
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作 用下转化成亚铁盐。此反应的离子方程式______。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。
(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
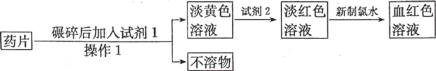
①操作1的名称是__________。
②试剂2为______溶液(填化学式)。
③加入新制氯水,溶液中发生反应的离子方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:称取25.0 g样品溶于稀硫酸中,加热搅拌,滤去不溶物。向滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,消耗KMnO4溶液25.00 mL。
(1)该铁矿石中铁元素的质量分数为________(保留三位有效数字);
(2)氧化物FemOn的化学式中m=____,n=____(m、n为正整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】马尾藻和海带中都含丰富的碘,可从中提取碘单质,实验室选取常见的海带设计并进行了以下实验:

(1)操作①的名称为___________。
A.萃取 B.分液 C.蒸发结晶 D.过滤
(2)步骤③中所用的分液漏斗使用前须进行检漏,试简述其操作______。
(3)步骤②加入H2O2和H2SO4溶液,反应的离子方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应在生产生活中有广泛的应用,回答下列问题。
(1)实验室中常用浓盐酸和二氧化猛混合加热制备氯气,下列反应中盐酸所体现的性质与该反应相同的是________
a.Zn+2HCl=ZnCl2+H2↑
b.KClO3+6HCl=KCl+3Cl2↑+3H2O
c.2HCl![]() H2↑+Cl2↑
H2↑+Cl2↑
d.2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
(2)向硫酸酸化的髙锰酸钾溶液中滴加H2O2溶液,高锰酸钾备液褪色并有气泡冒出,该反应中氧化剂与还原剂的物质的量之比为______,若生成标准状况下3.36 L气体时转移的电子数为________。
(3)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学计盘在化学中占有重要地位,请回答下列问题。
(1)相同质量的SO2和SO3所含氧原子的个数比为______。
(2)质量相同的A、B两种气体,在同温同压下,A的分子数比B多,则A的密度_____ B的密度(填>、=、<)。
(3)焦亚硫酸纳(Na2 S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。果脯中的Na2 S2O5的使用量是以游离的SO2来计算的,我国规定每千克果脯中SO2的最高含量是0.35g。
①下列试剂可用于检测SO2的是_________。
A.I2 B.HC1 C. H2SO4 D.CS2
②某500g果脯样品经检测得知含有SO2的物质的量为0.005 mol,该产品是否合格_________ (填“是”或“否”)。
(4)“84消毒液”是常用的含氯消毒剂,可以利用Cl2与NaOH反应制得该产品。反应的离子方程式为_______。“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制1 000 mL 0.50 mol L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用量筒量取浓硫酸的体积为_________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用含结晶水的盐X(四种短周期元素组成的纯净物)进行了如下实验:
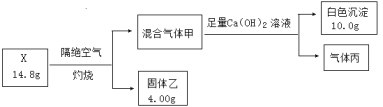
已知:i.气体甲无色无味气体;
ii.气体丙为纯净物,干燥后体积为2.24L(标况下),标况下密度为1.25g·L-1,易与血红蛋白结合而造成人中毒;
iii.固体乙为常见金属氧化物,其中氧元素的质量分数为40%。
请回答:
(1)X中除H、O两种元素外,还含有_____元素,混合气体甲的成分是_____(填化学式)。
(2)将X加入到硫酸酸化的高锰酸钾溶液,溶液褪色并有气体产生,写出该化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液A可能含有Na+、NH4+、Mg2+、Fe3+、Ba2+、Clˉ、SO42-、Iˉ、CO32-、HCO3-离子中的若干种。取该溶液进行如下实验:(已知Ag2SO4微溶于水,可溶于硝酸):

下列说法正确的是
A.溶液A中一定没有Ba2+,可能存在SO42-
B.白色沉淀甲一定为Mg(OH)2
C.溶液A中一定存在NH4+、Clˉ,一定不存在Fe3+、Iˉ、CO32-
D.判断溶液A中是否存在Fe3+,需向溶液A中加入KSCN溶液观察溶液是否变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
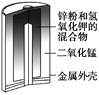
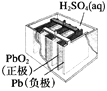
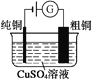
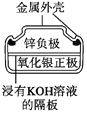
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com