
科目: 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目: 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是一种重要的化工产品,也是重要的化工原料。某化学兴趣小组在实验室制备氨并完成相关性质实验。
I.实验室制取氨气通常有两种方法:①固体氢氧化钙与氯化铵共热制备氨气(装置如图 甲②在锥形瓶中加入NaOH固体,在分液漏斗中加入浓氨水制备氨气(装置如图乙)。请回答:
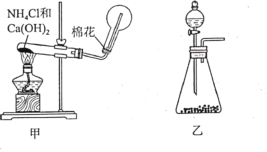
(1)用方法①制备并收集NH3 。装置甲中生成NH3的化学方程式为______。用圆底烧瓶收集NH3的方法为_____(填“向上排空气法”或“向下排空气法”),检验圆底烧瓶中已收集满氨气的方法是_______。
(2)利用装置乙可用方法②制取氨气,利用该装置还可制取_____(填字母)等气体。
a.H2 b.CO2 c.Cl2
II.该化学兴趣小组设计了如图所示的实验装置模拟工业生产制备少量硝酸。
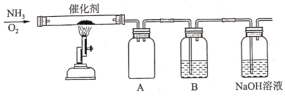
(1)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后移走酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是______反应(填“吸热”或“放热”)。
(2)B中试剂为 __________,NaOH溶液的作用是________。
(3)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟,白烟的化学式是_________。欲使氨气尽可能完全转化为_______,理论上n(NH3) : n(O2)的最佳比例为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①C(s、金刚石) + O2(g)=CO2(g) ΔH1=-395.4 kJmol-1,② C(s、石墨) + O2(g)=CO2(g) ΔH2=-393.5 kJmol-1 上述反应中的能量变化如图所示,下列说法正确的是
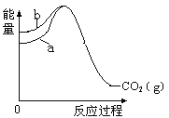
A.石墨和金刚石之间的转化是物理变化
B.图中 b 代表反应①的能量变化
C.C(s、金刚石) =C(s、石墨) ΔH= +1.9 kJmol-1
D.金刚石比石墨的热稳定性好
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目: 来源: 题型:
【题目】肾上腺素是缓解心跳微弱、血压下降、呼吸困难等症状的激素类药物,以下是某研究小组合成该药物的反应流程。
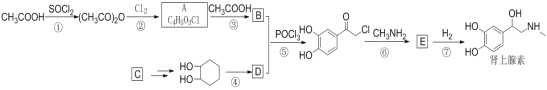
已知:i. CH3Cl![]() CH3NHCH2CH3
CH3NHCH2CH3
ii.![]() +
+![]()
![]()
![]()
iii.![]()
![]()
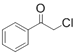
请回答:
(1)下列说法不正确的是____。
A.反应②属于取代反应 B.E的分子式为C9H10NO3
C.肾上腺素中含有三种不同类型的官能团 D.D遇FeCl3溶液显紫色
(2)化合物B的结构简式是___________。
(3)写出反应⑥的化学反应方程式____________。
(4)请设计以C(烃类)和乙烯为原料合成![]() 的合成路线______(用流程图表示,无机试剂任选)。
的合成路线______(用流程图表示,无机试剂任选)。
(5)写出同时满足下列条件的E的所有同分异构体的结构简式_____________。
①IR谱显示分子中存在苯环、硝基、以及醚键
②1H-NMR谱表明分子中有3种不同环境的氢原子
查看答案和解析>>
科目: 来源: 题型:
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是
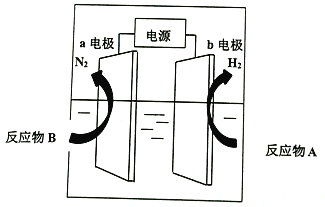
A. a为阳极,CO(NH2)2发生氧化反应
B. b电极反应为:2H2O+2e-=H2↑+2OH-
C. 每转移6mol电子,a电极产生1molN2
D. 电解一段时间,a极区溶液pH升高
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池作为安全性能较好的一类化学电源得到了更快的发展,一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法正确的是
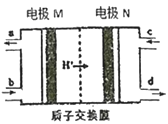
A. M极生成氮气且电极附近pH降低
B. 负极上每消耗1 mol N2H4,会有2 molH+通过质子交换膜
C. 正极的电极反应式为:O2+2H2O+4e-=4OH-
D. 电极M是原电池的正极
查看答案和解析>>
科目: 来源: 题型:
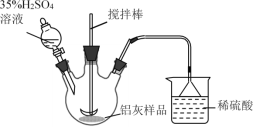
【题目】铝生产加工过程中产生大量的铝灰,直接掩埋造成铝资源浪费,还会带来严重的污染。某铝厂的铝灰经分析所含主要物质如下:Al、Al2O3、AlN、SiO2、Fe2O3,其他杂质均不溶于稀硫酸。如图是酸浸法用该铝灰生产高纯氧化铝的生产流程:
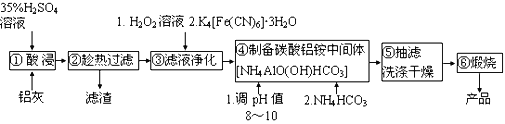
已知:i.Fe3+ +K++ [Fe(CN)6]4-=K[Fe(CN)6Fe]↓
ii.AlN常温下与水缓慢反应,酸性或碱性条件下反应较快
iii.NH4AlO(OH)HCO3难溶于碱性溶液和乙醇
请回答:
(1)实验室模拟工业生产①酸浸步骤的装置如图,该装置的不合理之处为____。
(2)步骤③加入H2O2溶液的目的是________________。
(3)步骤④调节pH最合适的试剂是________________。
A.NaOH B.H2SO4 C.NH3·H2O D.Ca(OH)2
(4)步骤⑤吸滤瓶内液体高度快达到支管口位置时应拔掉瓶上橡皮管,_______,洗涤沉淀操作为_______________。
(5)写出煅烧碳酸铝铵中间体得到高纯氧化铝的化学方程式______________。
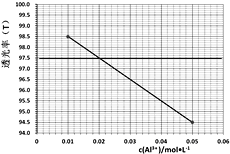
(6)已知Al3+对光的吸收与其浓度成线性关系,色度计传感器可以测量某种波长的光穿过溶液的透射率确定溶液浓度。如图是红色光照下透光率(T)对应c(Al3+)的标准曲线。为测定铝灰中铝元素的回收率,准确称取0.5000g铝灰(折合铝元素含量60.00%)进行制备高纯氧化铝的实验,将所制得的粉末与固体NaOH反应后加水溶解、过滤,滤液定容到250mL容量瓶中。用移液管移取25.00mL到锥形瓶中,加2滴指示剂,滴加稀盐酸至溶液体积变为50.00mL,NaAlO2恰好反应生成AlCl3。取该溶液于比色皿中进行色度检测,测得溶液透光率为97.5,则铝元素的回收率=_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯腈(C3H3N)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下。
①C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
②C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=353 kJ·mol1
请回答下列各题:
(1)关于上述反应,下列说法正确的是____。
A.增大压强有利于提高丙烯腈平衡产率
B.反应②的ΔS等于零
C.可以选择合适的催化剂来提高混合气中丙烯腈的生产效率
D.上述反应在恒温、恒容密闭容器中进行,若H2O(g)浓度保持不变,则说明两反应均达到平衡状态
(2)一定温度下,在体积不变的容器中充入C3H6、NH3、O2各1mol,一定时间后反应达到平衡状态,测得容器内C3H6和H2O的物质的量分别为0.4mol和1.4mol,该温度下反应②的平衡常数为____。
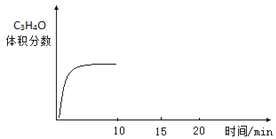
(3)若向容器内充入3mol C3H6和1mol O2只发生反应②,一定时间达到平衡状态,10min时再充入1mol O2,15min重新达到平衡,请在图中画出10min~20min内C3H4O的百分含量的变化图__________。
(4)如图为一定时间内丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。下列说法正确的是_____。

A.460℃之前产率随温度升高而增大是因为随温度升高反应平衡常数变大
B.高于460℃产率下降的原因可能是温度升高催化剂活性降低
C.460℃时C3H6的转化率一定大于500℃
D.温度过高副反应可能变多不利于合成丙烯腈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com