
科目: 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18个电子,五种化合物间的转化关系如图所示。下列说法错误的是( )
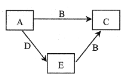
A. X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低
B. Y的最高价氧化物的水化物为弱酸
C. Y、Z组成的分子可能为非极性分子
D. W是所在周期中原子半径最小的元素
查看答案和解析>>
科目: 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体A在一定条件下加热分解,产物都是气体。分解的方程式为:2A=B↑+2C↑+2D↑。测得生成的混合气体对H2的相对密度为d,则A的相对分子质量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】 合成氨工业生产中所用的α—Fe催化剂的主要成分为FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,此时混合物中铁的质量分数为__________________(保留两位小数)。
(3)写出由C(炭粉)与Fe2O3在高温下反应制备α—Fe催化剂的化学方程式(另一种产物可溶于水):________________。
(4)为制得这种活性最高的催化剂,理论上应向480gFe2O3粉末加入炭粉的质量是______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准状况下,4.48 L NH3所含分子数为____________。___molCO2中含有氧原子数与1.806×1024个H2O分子含有的氧原子数相同
(2) 1.7g H2O2中含有氧原子的物质的量为 _________mol,电子数目为 _____,已知ag H2O2中含原子数为b,则阿伏伽德罗常数为 _________(用含a、b的代数式表示)
(3)8.4 g N2与9.6 g某单质Rx,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是_______,x值为_______。并写出R原子的原子结构示意图_________
(4)标况下等质量的O2与O3的体积之比为 ______,氧原子个数之比为 ______。
(5)在一密闭容器中充入a molNO和b molO2,可发生如下反应 2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比__________
查看答案和解析>>
科目: 来源: 题型:
【题目】将符合反应类型的反应的序号填在下列分类方法后的横线上
A.4Fe3O4+O2![]() 6Fe2O3
6Fe2O3
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.Zn+H2SO4=ZnSO4+H2↑
D.CaCO3+2HCl=CaCl2+H2O +CO2↑
E.CH4+2O2![]() CO2+2H2O
CO2+2H2O
F. 3O2![]() 2O3
2O3
G.CuO+H2![]() Cu+H2O
Cu+H2O
H.H2SO4+2NaOH=Na2SO4+2H2O
①属于化合反应的是____(填字母,下同)
②属于分解反应的是____;
③属于复分解反应的是____;
④属于置换反应的是____;
⑤既不属于四种基本反应类型又不属于氧化还原反应的是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是用来衡量微观粒子多少的一种物理量
B.标况下O2的体积取决于O2分子间的距离
C.常温常压下4.8g O3含有的氧原子为0.3NA
D.若气体摩尔体积为22.4 L/mol,,则所处条件为标准状况
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是

A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C为同一主族,C常用于制作半导体器件和集成电路,B的简单氢化物的水溶液呈碱性,E元素的正三价离子的3d亚层为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,其在周期表中位于第4周期、第ⅣB族。
(1)A、B、C三种元素的第一电离能由小到大的顺序为______________________,电负性由小到大的顺序为____________________。
(2)B的简单氢化物易液化的原因是_______________;BH4+中B原子的杂化方式为___________,空间构型为__________________。
(3)E元素基态原子的电子排布式为____________________________________。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于__________________晶体。
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为__________________;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为__________________g·cm-3(用含a和NA的代数式表示)。
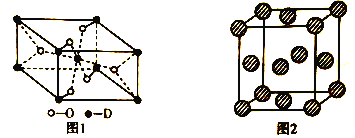
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com