
科目: 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“●”代表一种元素,其中A代表氢元素。
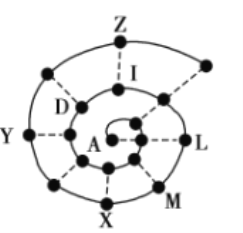
(1)X的元素符号为______,I元素在周期表中的位置为______。
(2)M与Z两种元素形成的化合物的化学式为______。
(3)下列说法正确的是______(填序号)。
a.I元素形成的单质通入LZ的溶液中可得Z元素形成的单质
b.虚线相连的元素处于同一主族
c.L元素形成的单质在D元素形成的单质中燃烧生成![]()
d.X、Y、M元素为同周期元素
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y均为短周期元素,且![]() 比
比![]() 的电子层数多,下列说法正确的是( )
的电子层数多,下列说法正确的是( )
A.Y可能是第一周期元素
B.X和Y一定位于相邻的两个周期
C.a一定比b小
D.a+m+n-b的值一定为8
查看答案和解析>>
科目: 来源: 题型:
【题目】检验甲醛含量的方法有很多,其中银﹣Ferrozine法灵敏度较高。测定原理为甲醛把氧化银还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪(Ferrozine)形成有色配合物,通过测定吸光度计算出甲醛的含量。某学习小组类比此原理设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略去)。

已知:甲醛能被银氨溶液氧化生成CO2,氮化镁与水反应放出NH3,毛细管内径不超过1 mm。请回答下列问题:
(1)A装置中反应的化学方程式为___________,用饱和食盐水代替水制备NH3的原因是___________________。
(2)B中装有AgNO3溶液,仪器B的名称为________。
(3)银氨溶液的制备。关闭K1、K2,打开K3,打开______,使饱和食盐水慢慢滴入圆底烧瓶中,当观察到B中白色沉淀恰好完全溶解时,________。
(4)室内空气中甲醛含量的测定。
①用热水浴加热B,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1 L室内空气,关闭K1;后续操作是______________;再重复上述操作3次。毛细管的作用是__________。
②向上述B中充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,充分反应后立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562 nm处测定吸光度,测得生成Fe2+1.12 mg,空气中甲醛的含量为____mg·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Cu2S(s)![]() CuO(s)
CuO(s)![]() CuCl2(aq)
CuCl2(aq)
B.SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D.NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)键线式![]() 的系统命名为 __________________;
的系统命名为 __________________;
(2) 中含有的官能团为_______________;
中含有的官能团为_______________;
(3)2-甲基-1-丁烯的结构简式____________________;
(4)相对分子质量为 72 且一氯代物只有一种的烷烃的结构简式________________;
(5)分子式为 C2H6O 的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是________________;
A.红外光谱 B.核磁共振氢谱 C.质谱法 D.与钠反应
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B两种溶液分别含有下列十种离子中的各不相同的五种:H+、Al3+、Na+、Cu2+、![]() 、OH-、
、OH-、![]() 、
、![]() 、
、![]() 、Cl-。下列判断正确的是( )
、Cl-。下列判断正确的是( )
A.若A溶液为无色溶液,则A溶液中可能含有:H+、Al3+、Cl-、![]() 、
、![]()
B.若A溶液有强还原性,则B溶液中可能含有:H+、Cu2+、Al3+、Cl-、![]()
C.若B溶液呈强碱性,则A溶液中可能含有:H+、Al3+、Na+、Cu2+、![]()
D.若B溶液有强氧化性且各离子浓度相同,则B溶液可能含有:H+、Al3+、Cu2+、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2固体(溶液体积变化、温度变化忽略不计),测得溶液中离子浓度的关系如图所示,下列说法正确的是( )
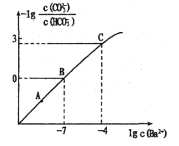
已知:Ksp(BaCO3)=2.40![]() 10-9
10-9
A.A、B、C三点对应溶液pH的大小顺序为:A>B>C
B.A点对应的溶液中存在:c(CO32-)< c(HCO3-)
C.B点溶液中 c(CO32-)=0.24mol/L
D.向C点溶液中通入CO2可使C点溶液向B点溶液转化
查看答案和解析>>
科目: 来源: 题型:
【题目】常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:
=10-12的溶液中:![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
B.滴加KSCN溶液显红色的溶液中:![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、![]()
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁的工艺流程如图所示:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
回答下列问题:
(1)TiOSO4中钛元素的化合价是____________,步骤①中分离硫酸亚铁溶液和滤渣的操作是___________。
(2)滤渣的主要成分为TiO2·xH2O,结合离子方程式解释得到滤渣的原因:________。
(3)从硫酸亚铁溶液中得到硫酸亚铁晶体的操作方法是____________________;硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应的氧化剂和还原剂的物质的量之比为______。
(4)步骤④中发生反应的离子方程式为______________________。
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及____________________。
(6)实验室中检验溶液B中主要阳离子的方法是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,甘氨酸在水溶液中解离情况如下:H3N+CH2COOH(A+)![]() H3N+CH2COO-(A±)
H3N+CH2COO-(A±)![]() H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
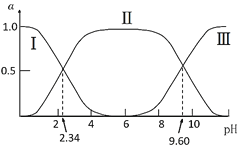
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A、A±、A+
B.K2=102.34,且K2对应的解离基团为-NH3+
C.在pH=9.60的溶液中加盐酸,α(A±)+α(A+)+α(A)保持不变
D.甘氨酸的等电点pH约为6,且存在c(A±)=c(A+)=c(A)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com