
科目: 来源: 题型:
【题目】现有几组物质的熔点数据如表所示。
A组 | B组 | C组 | D组 |
金刚石:3550℃ |
|
|
|
硅晶体:1410℃ |
|
|
|
硼晶体:2300℃ |
|
|
|
二氧化硅:1723℃ |
|
|
|
请回答下列问题:
(1)A组属于______晶体,其熔化时克服的微粒间的作用力是______。
(2)B组晶体共同的物理性质是______(填序号)。
A.有金属光泽 B.有导电性 C.有导热性 D.有延展性
(3)C组中酸性最弱的是______,最不稳定的是______。
(4)D组晶体可能具有的性质是______(填序号)。
A.硬度小 B.水溶液能导电 C.固体能导电 D.熔融状态下能导电
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案,不能达到相应实验目的的是( )
A | B | C | D | |
实验方案 |
|
|
将NO2球浸泡在冷水和热水中 |
|
实验目的 | 探究反应物浓度对化学平衡的影响 | 探究催化剂对反应速率的影响 | 探究温度对化学平衡的影响 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】在20世纪90年代末,科学家发现碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
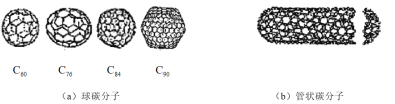
A.金刚石和石墨的熔点肯定比![]() 高
高
B.熔点:![]()
C.球碳分子、管状碳分子和洋葱状碳分子都是分子晶体,都是碳的同素异形体
D.金刚石以非分子形式的粒子存在,属于原子晶体;![]() 、
、![]() 、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
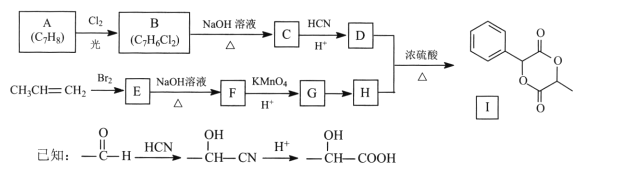
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】固体![]() 的化学式为
的化学式为![]() ,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
A.![]() 中既有离子键又有共价键B.
中既有离子键又有共价键B.![]() 的熔、沸点高于
的熔、沸点高于![]()
C.![]() 中含有
中含有![]() 键D.
键D.![]() 形成的晶体是离子晶体
形成的晶体是离子晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )

A.若a=4,则A是强酸,B是弱酸
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.稀释前两种酸溶液的浓度:c(A)>c(B)
D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得,反应装置如图(部分装置省略),反应原理如下:
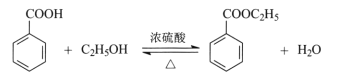
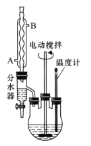
实验操作步骤:
①向三颈烧瓶内加入12.2g苯甲酸、25mL乙醇、20mL苯及4mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210-213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8mL。
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
苯甲酸 | 122 | 1.27 | 249 | 微溶于水,易溶于乙醇、乙醚 |
苯甲酸乙酯 | 150 | 1.05 | 211-213 | 微溶于热水,溶于乙醇、乙醚 |
乙醇 | 46 | 0.79 | 78.5 | 易溶于水 |
乙醚 | 74 | 0.73 | 34.5 | 微溶于水 |
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______,其作用是____
(2)步骤①中加浓硫酸的作用是_________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是_________。
(4)步骤③中加入碳酸钠的目的是________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)本实验所得到的苯甲酸乙酯产率是________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>____________。基态K+电子占据最高能级的电子云轮廓图为________形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______,中心原子的杂化形式为_______。NaBH4中存在_____(填标号)。
a. 离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为________,其中Be的配位数为_______。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:_____________________。
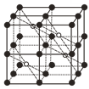
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是________。若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com