
科目: 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
科目: 来源: 题型:
【题目】利用工业废气 CO2 或 CO 和 H2 在一定条件下可制备燃料甲醇。
Ⅰ.利用工业废气 CO 合成甲醇,其能量变化示意图如下:
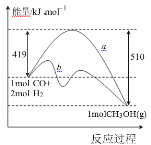
(1)图中曲线 a 到曲线 b 的措施是_______。该反应 ΔS________0(填“>”或“<”)
(2)一定条件下,在 2 L 密闭容器中充入 1 mol CO 和 2 mol H2,10 min 后达到平衡,放出热量 45.5kJ,则 10 min 内 H2 的转化率为_____;该温度下反应的平衡常数 K=_____;达到平衡后,再向容器中充入 CO、H2、CH3OH 各 1 mol,则此时 υ正_____υ逆 (填“>”“<”或“=”)
(3)下列措施可以提高甲醇产率的是_____。
a.压缩容器体积
b.将 CH3OH (g)从体系中分离
c.恒容条件下充入He,使体系总压强增大
d.恒压条件下再充入 10mol CO 和 20mol H2
(4)现有容积均为 1L 的 a、b、c 三个密闭容器,向其中分别充入 1molCO 和 2molH2 的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b 中甲醇体积分数大于 a 中的原因是_______达到平衡时,a、b、c 中 CO 的转化率大小关系为_______。
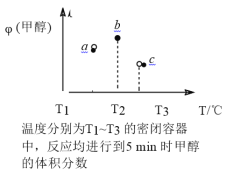
Ⅱ.用工业废气中的 CO2制取甲醇和水蒸气
(5)一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
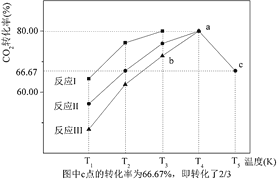
①催化剂效果最佳的反应是_____(填“反应 I”,“反应 II”,“反应 III”)。
②b 点υ正_____υ逆(填 “>”, “<”, “=”)。
③若此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因是_____。
④c点时该反应的平衡常数K=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
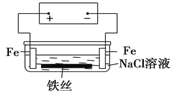
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法中正确的是( )
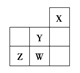
A. Y的原子半径在同周期主族元素中最大
B. W的非金属性比Z的弱
C. Z的气态氢化物的稳定性在同主族元素中最强
D. W的最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答:
(1)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12(如图1)由此可以得到的结论是___(填字母)。

a.NH3·H2O是弱碱
b.溶液中c(H+)>c(OH-)
c.NH4+水解是吸热反应
d.由H2O电离出的c(H+)<10-7mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(2)室温下,用0.10mol/LNaOH溶液分别滴定20.00mL0.10mol/L的盐酸和醋酸,滴定曲线如图2所示。
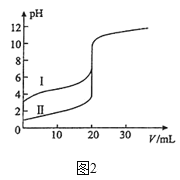
①表示滴定盐酸的曲线是____(填序号)。若此实验选用酚酞为指示剂,则滴定到达终点的现象是____。若用标准NaOH溶液测定未知盐酸溶液的浓度,下列实验操作会使实验结果偏低的是____。
a.锥形瓶用待测液润洗后再注入待测液
b.碱式滴定管滴定前有气泡,滴定后无气泡
c.碱式滴定管滴定前仰视读数,滴定后平视读数
②在滴定醋酸溶液的过程中:
V(NaOH)=10.00mL时,溶液中离子浓度由大到小的顺序为____。当c(Na+)=c(CH3COO-)+c(CH3COOH)时,溶液pH____7(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锗和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是
A.锗不能与强碱溶液反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为![]()
查看答案和解析>>
科目: 来源: 题型:
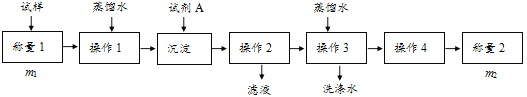
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
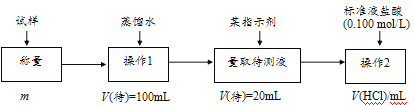
方法二:
方法四:不使用化学试剂,使用实验室常用仪器。
(1)方法一:加入足量的试剂A___(填写A的化学式)可将HCO3-离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、___、洗涤和干燥;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒外,还需要的用到的是___,在操作2中应选择甲基橙指示剂;
(3)在方法二中计算该样品中NaHCO3的质量分数为___[用流程图中的数据m、V(HCl)填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是___;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是___,偏低的原因可能是___(均文字简述);
(6)方法四的实验原理是:___(用化学方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知水在25℃和100℃时,其电离平衡曲线如图所示:

①则25℃时水的电离平衡曲线应为_____。(填“A”或“B”)
②25℃下,下列三种溶液中,由水电离出的氢离子的物质的量浓度之比a:b:c=_____。
a.pH=1的盐酸b.pH=2的盐酸c.pH=12的NaOH溶液
③25℃下,若VaLpH=a的盐酸与VbLpH=b的NaOH溶液恰好中和,a+b=13,则Va:Vb=_____。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=13。
①该温度下水的Kw=_____。
②此温度下,将pH=1的盐酸溶液VaL与pH=14的NaOH溶液VbL混合(忽略体积变化),混合后溶液的pH为2,则Va:Vb=_____。
(3)下列说法中正确的是_____。
a.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液pH>7
b.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液pH=7
c.25℃时,由水电离出的氢离子浓度为1×10-10mol/L的溶液中可能大量存在NH4+和Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】铊是超导材料的组成元素之一,铊在周期表中位于第6周期,与铝是同族元素,元素符号是![]() 。下列对铊及其化合物的性质的推断正确的是
。下列对铊及其化合物的性质的推断正确的是
A.![]() 的金属性强于
的金属性强于![]()
B.能生成![]() 价的化合物
价的化合物
C.铊的氢氧化物的碱性比铝弱
D.![]() 与
与![]() 都具有两性
都具有两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com