
科目: 来源: 题型:
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素. 铁、钴、镍都是很好的配位化合物形成体.
(1)[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。H2O 和 N H3 中与 Co2+配位能力较强的是_____,[Co(H2O)6]2+中 Co2+的配位数为___;从轨道重叠方式看,NH3 分子中的化学键类型为___ , H2O 分子的立体构型为___。
(2)铁、镍易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数 遵循 18e-规则。如:Fe(CO)5,则镍与 CO 形成的配合物化学式为_________。常温下 Fe(CO)5 为 黄色油状液体,则 Fe(CO)5 固态为_____晶体。Fe(CO)5 晶体中存在的作用力有___,写出与 CO 互为等电子体的一种阴离子的离子符号_____,Fe(CO)5 中σ键和π键数目之比为______。
(3)一种铁单质其晶胞与钠、钾晶胞相同,如果该铁单质的晶胞参数为 a cm,则相距最近的两 个铁原子核间距为_____cm (用含 a 的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。 制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如下:
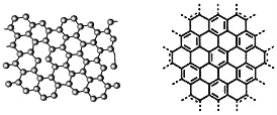
(1)下列有关石墨烯说法正确的是_____。
A 石墨烯的结构与金刚石相似 B 石墨烯分子中所有原子可以处于同一平面
C 12g 石墨烯含σ键数为 NA D 从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含 碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为:_____。
②乙醇沸点比氯乙烷高,主要原因是___________________。
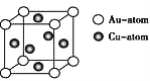
③下图是金与铜形成的金属互化物合金,它的化学式可表示为:_______ 。
④含碳源中属于非极性分子的是______________(填序号)
a 甲烷 b 乙炔 c 苯 d 乙醇
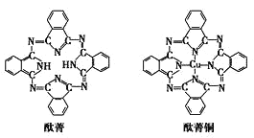
⑤酞菁与酞菁铜染料分子结构如下图,组成酞菁铜染料分子的元素,酞菁变成酞菁铜,分子中多 了什么作用力_____,酞菁铜分子中设计到的元素,电负性由小到大依次为_____
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃时,将agNH3完全溶于水,得到VmL溶液,设该溶液的密度为ρgcm-3,质量分数为ω,其中含NH4+的物质的量为bmol。下列叙述中不正确的是( )
A.溶质的质量分数为ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() molL-1
molL-1
C.溶液中c(OH-)=![]() mol/L
mol/L
D.上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5ω
查看答案和解析>>
科目: 来源: 题型:
【题目】根据信息填空
①某元素原子基态核外电子有 14 种不同的运动状态,该元素位于第_____周期第_____族
②外围电子排布式为 3d54s2 的原子,其原子结构示意图为_____,其最高正价为_____价
③Fe2+的价电子排布图为_____
④33 号元素的核外电子排布式简写形式为_____,属于__________区
⑤前四周期未成对电子最多的元素,其基态核外电子占据的轨道数目为_____
⑥《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3 中,阴离子空间构型为_____,C 原子的杂化形式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1)
2NH3(g) ΔH=-92.4kJ·mol-1)

下列说法正确的是( )
A.2c1>c3B.a+b=92.4C.2p1<p3D.α1+α3>1
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )
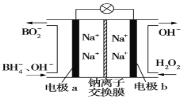
A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗1molH2O2,转移的电子为1mol
D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1![]() 分别投入足量的0.1
分别投入足量的0.1![]() 的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计______(填“合理”或“不合理”),理由是________________________。
。此设计______(填“合理”或“不合理”),理由是________________________。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
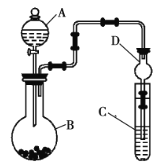
(3)仪器![]() 的名称为____________,干燥管
的名称为____________,干燥管![]() 的作用是__________________。
的作用是__________________。
(4)实验室中现有药品:![]() 溶液、
溶液、![]() 浓盐酸、
浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置![]() 、
、![]() 、
、![]() 中所装药品分别为____________、____________、____________,装置
中所装药品分别为____________、____________、____________,装置![]() 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
(5)若要证明非金属性:![]() ,则
,则![]() 中加__________,
中加__________,![]() 中加
中加![]() ,
,![]() 中加__________,观察到
中加__________,观察到![]() 中的现象为______________________________。
中的现象为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下存在反应:H2(g)+I2(g)![]() 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C. 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目: 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com