
科目: 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
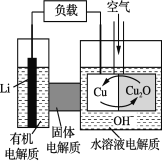
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是( )
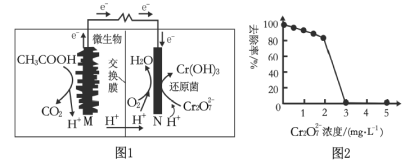
A.图1燃料电池工作一段时间后,N极附近的溶液pH增大
B.外电路转移2 mol电子时,N极消耗标准状况下11.2 L O2
C.图2中Cr2O72-浓度较大时,其去除率下降可能是Cr2O72-浓度较大造成还原菌失活所致
D.M极为电池负极,发生的电极反应为CH3COOH+2H2O-8e-=2CO2↑+8H+
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是
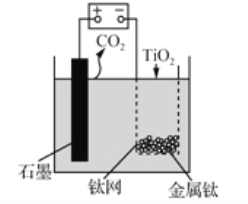
A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目: 来源: 题型:
【题目】对金属制品进行腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是__________________(用离子方程式表示)。
为将碱洗后槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的__________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为________________________________________________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________________________________________________________。
(3)利用如图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
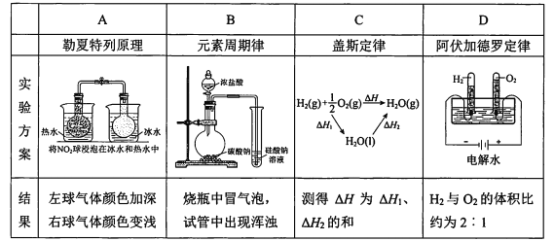
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体相对于氢气的密度为9.5,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为( )
A.![]() mLB.
mLB.![]() mLC.
mLC.![]() mLD.无法判断
mLD.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
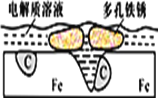
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
Cr2O72﹣+ Fe2++ H+- Cr3++ Fe3++ H2O
现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2molL-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1molL-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步中离子方程式___。
(2)计算工业甲醇的质量分数___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与阿伏加德罗常数的值(NA)有关的说法正确的是
A. 标准状况下,44.8LHF中含有氢原子的数目为2NA
B. 8.0gCu2S和 CuO的混合物中含有铜原子数为0.1NA
C. 0.2mol·L-1的碳酸钠溶液中CO32-的数目小于0.2NA
D. 1LpH=3的盐酸与1LpH=3的CH3COOH溶液中,水电离出的H+数目均为10-3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。其他相关数据如表:
O=O | H—H | H—O(g) | |
键能/(kJ·mol-1) | 496 | 436 | x |
则表中x为
A.920B.557C.463D.188
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com