
科目: 来源: 题型:
【题目】物质A~D均含同种元素,都是中学化学中常见的物质,它们之间可发生如图所示的反应(除A~D外的其他物质均已略去)。
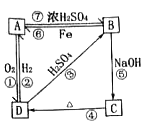
(1)写出相应物质的类别。
物质 | B | C | D |
类别 | ___ | __ | __ |
(2)上述反应①到⑥中,属于离子反应的有___个。
(3)①D→A转化的化学方程式:__。
②B→C转化的离子方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体化合物A,按图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。

回答下列问题:(1)物质A是___(填化学式)。
(2)反应②的离子反应方程式为___。
(3)反应④的化学反应方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一条河边有四座工厂:甲、乙、丙、丁(如图所示),它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种。某环保小组对河水监测时发现:

①甲处河水呈乳白色
②乙处河水有红褐色沉淀
③丙处河水由浑浊变澄清
④丁处河水产生气泡,河水仍澄清
请推断四座工厂排出的废液里含有的物质分别是(填化学式):
甲:___,乙:___,丙:___,丁:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molNa2O2与SO2完全反应,转移2NA个电子
B. 标准状况下,11.2L乙醇中含有的极性共价键数目为3.5NA
C. 18g的D2O中含有的中子数为10NA
D. 1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式:__________________。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是________。设计实验检验绿矾是否完全变质:________________。
(3)(I)利用绿矾制备还原铁粉的工业流程如下:
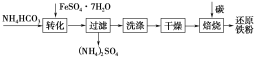
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为_____________________。
②取干燥后的FeCO3样品12.49 g,焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量为________g。(FeOOH也能被C还原得到Fe)
(II)用下列方法可制得Fe(OH)2白色沉淀:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。
②除去蒸馏水中溶解的O2常采用________的方法。
③生成白色沉淀Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2014年3月22日是第二十二届“世界水日”,保护水资,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_______倍。
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN。[Au(CN)2]+的一级电离方程式:__________________________;在碱性条件下NaClO将废水中的CN-氧化成CO![]() 和N2,其反应的离子方程式为: _______________________________________________ 。
和N2,其反应的离子方程式为: _______________________________________________ 。
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如下图所示:

请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为_______________________________。
③试确定NO3-是否存在?_________________(填“存在”、“不存在”或“不确定”),若存在,试计算c(NO3-)_________________(若不存在,此问不必作答)。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,某溶液X中所含ClO2浓度(g·L-1)的实验测定步骤如下:步骤1. 配制Na2S2O3溶液:准确称取1.984 0 g Na2S2O3·5H2O,用新煮沸并冷却的蒸馏水配成100.00 mL溶液。步骤2. 准确移取1.00 mL溶液X加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+===5I2+2Cl-+4H2O),在暗处放置5 min。步骤3. 向步骤2的锥形瓶的反应液中加入1 mL淀粉溶液作指示剂,再向其中滴加步骤1配制的Na2S2O3溶液(发生反应I2+2Na2S2O3===2NaI+Na2S4O6),至恰好完全反应时消耗Na2S2O3溶液25.00 mL。
(1)步骤1中所配Na2S2O3溶液的物质的量浓度为____mol·L-1,所用玻璃仪器除烧杯、胶头滴管外还有____。(2)配制Na2S2O3溶液时,蒸馏水需煮沸的原因是____。
(3)计算溶液X中所含ClO2浓度(g·L-1)(写出计算过程)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组设计如下图实验装置进行实验。

(1)为了实现绿色环保的目标,能否用上图A2代替A1装置______(填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为____________
C中反应的离子方程式为__________________________,D中反应的化学方程为___________________。
(3)氨水吸收过量SO2的反应的离子方程式为__________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用![]() 与浓盐酸反应制备
与浓盐酸反应制备![]() 。
。
(1)制备反应会因盐酸浓度下降面停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量![]() 溶液反应,称量生成的
溶液反应,称量生成的![]() 质量。
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与己知量![]() (过量)反应,称量剩余的
(过量)反应,称量剩余的![]() 质量。
质量。
丁方案:与足量![]() 反应,测量生成的
反应,测量生成的![]() 体积。
体积。
继而进行下列判断和实验:
①判定甲方案不可行。现由是_________。
②进行乙方案实验;准确量取残余清液稀释一定倍数后作为试样。
a.量取试样![]() ,用
,用![]() 标准溶液滴定,选择的指示剂是____,消耗
标准溶液滴定,选择的指示剂是____,消耗![]() ,该次滴定测得试样中盐酸浓度为_______
,该次滴定测得试样中盐酸浓度为_______![]()
b._________,获得实验结果。
③判断两方案的实验结果________(填“偏大”、“偏小”或“准确”).
[已知:![]() 、
、![]() ]
]
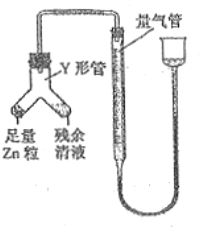
④进行丁方案实验:装置如图所示(夹持器具已略去)。
a.使Y形管中的残余清液与锌粒反应的正确操作是将_______转移到____中。
b.反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是__________(排除仪器和实验操作的影响因素),至体积不变时,量气管的左侧液面高于右侧液面,此时读数测得的体积__________(填“偏大”、“偏小”或“准确”)
(2)若没有酒精灯,也可以采用![]() 与浓盐酸反应制取适量氯气的如下简易装置。
与浓盐酸反应制取适量氯气的如下简易装置。
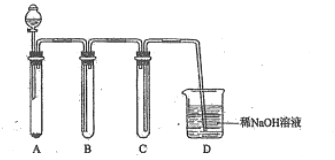
装置B、C、D的作用分别是:
B___________C______________D______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com