
科目: 来源: 题型:
【题目】(Ⅰ)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:HNCO+NO2→N2+CO2+![]() (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的数目为____________。
(Ⅱ)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566.0kJ mol﹣1;2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ mol﹣1;2H2O(g)═H2O(l)△H=﹣44.0kJ mol﹣1。
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:____________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJmoL﹣1。
2NH3(g)△H=﹣92.4kJmoL﹣1。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t3时引起平衡移动的条件可能是______,其中表示平衡混合物中NH3的含量最高的一段时间是______。

②温度为T℃时,将1mol N2和2mol H2放入容积为0.5L的密闭容器中,充分反应后测得N2的平衡转化率为50%.则反应在T℃时的平衡常数为______mol﹣2L2。
③目前工业合成氨的原理是:N2+3H2![]() 2NH3如图表示随条件改变,平衡体系中氨气体积分数的变化趋势,当横坐标为压强时,变化趋势正确的是(填序号,下同)___,当横坐标为温度时,变化趋势正确的是___。
2NH3如图表示随条件改变,平衡体系中氨气体积分数的变化趋势,当横坐标为压强时,变化趋势正确的是(填序号,下同)___,当横坐标为温度时,变化趋势正确的是___。

(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为____>____>____>____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O

请回答:
(1)甲池是___,通入O2的电极作为___极,电极反应式为_______.
(2)乙池是_____,A电极名称为__极,电极反应式为_________.
乙池中的总反应离子方程式为_________,一段时间后溶液的pH______(填“增大”、“减小”或“不变”).
(3)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2____mL(标准状况下).当丙为硫酸铜溶液且体积为500 mL,通电后丙溶液的pH=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。如图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
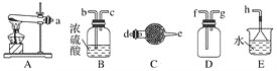
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接__、___接__,__接h;实验室用A装置制取NH3的化学方程式为___。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是___,试写出制纳米级碳酸钙的化学方程式:___。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关蛋白质的叙述不正确的是![]()
![]()
![]() 向蛋白质溶液里加
向蛋白质溶液里加![]() 溶液可提纯蛋白质
溶液可提纯蛋白质
![]() 蛋白质的分子能透过半透膜
蛋白质的分子能透过半透膜
![]() 蛋白质水解的最终产物是氨基酸
蛋白质水解的最终产物是氨基酸
![]() 温度越高,酶对某些化学反应的催化效率越高
温度越高,酶对某些化学反应的催化效率越高
![]() 任何结构的蛋白质遇到浓
任何结构的蛋白质遇到浓![]() 都会变黄色
都会变黄色
A.①②③B.②③⑤C.③④⑤D.②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀,可用于向瓶中鼓入空气的仪器)(已知常温下KMnO4固体与浓盐酸反应产生氯气)。

(1)氯水中含有七种粒子,其中的分子为__(化学式);需临时配制的原因是__(用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是__,烧杯中发生反应的化学方程式是__。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是__。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是__。
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂、蛋白质都是与生命息息相关的物质,下列有关说法正确的是![]()
![]()
A.葡萄糖和蔗糖是同系物,淀粉和纤维素是同分异构体
B.淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应
C.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”“泪”分别是纤维素和油脂
D.通过灼烧时产生的气味可以鉴别蚕丝和棉纱
查看答案和解析>>
科目: 来源: 题型:
【题目】Z是合成某药物的中间体,其合成原理如下:
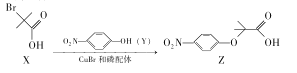
下列说法正确的是.
A.用NaHCO3溶液可以鉴别X和ZB.X、Y、Z都能发生取代反应
C.X分子所有碳原子可能共平面D.与X具有相同官能团的同分异构体还有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )

A. 名称是乙醚
B. 只含有一种官能团
C. 链状同分异构体中,属于羧酸的有3种
D. 既能发生加聚反应,又能发生缩聚反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com