
科目: 来源: 题型:
【题目】科学家最新研制的利用氯化氢和氢气生产高纯硅的工艺流程如图所示:
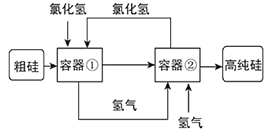
容器①中的反应为:Si(粗)+3HCl(g)=SiHCl3(l)+H2(g);容器②中进行的反应为:SiHCl3+H2=Si(纯)+3HCl,下列说法正确的是
A.反应①和②中HCl均作为氧化剂
B.该工艺流程的优点是部分反应物可循环使用
C.最好用分液的方法分离Si和SiHCl3
D.由反应①可知Si可与盐酸发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)电镀厂的废水中含有的CN有剧毒,需要处理加以排放。处理含CN废水的方法之一是在微生物的作用下,CN被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为__。
(2)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A表示乳酸根离子):
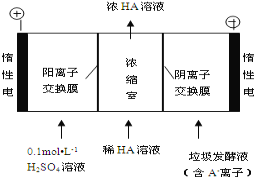
①阳极的电极反应式为___。
②简述浓缩室中得到浓乳酸的原理:__。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH可忽略不计。400mL10g/L乳酸溶液通电一段时间后,浓度上升为145g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为__L(提示:乳酸的摩尔质量为90g/mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】沉积物微生物燃料电池可处理含硫废水,其工作原理如图所示。下列说法错误的是( )

A.碳棒b的电极反应式为:O2+4e-+2H2O=4OH-
B.光照强度对电池的输出功率有影响
C.外电路的电子方向:碳棒a→碳棒b
D.酸性增强不利于菌落存活,故工作一段时间后,电池效率降低
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业上采用高温分解H2S制取氢气,2H2S(g)![]() 2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
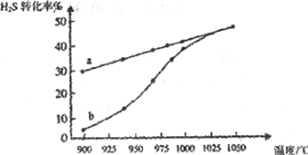
①反应2H2S(g)![]() 2H2(g)+S2(g)的ΔH__(填“>”“<’或“=”)0。
2H2(g)+S2(g)的ΔH__(填“>”“<’或“=”)0。
②985℃时,反应经过5s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2)=__。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是__。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
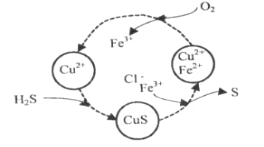
在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中尽可能不含CuS,可采取的措施有__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)今有常温下两种溶液:
(A)0.1mol·L-1NH3·H2O溶液 (B)0.1mol·L-1NH4Cl溶液
①溶液(A)的pH___7(填“>”“<”或“=”)。
②溶液(B)呈___性(填“酸”“碱”或“中”)。
③升高温度可以___(填“促进”或“抑制”)NH4Cl的水解。
④氮及其化合物在工农业生产、生活中有着重要作用。如图是1molNO2和1molCO反应生成NO和CO2过程中能量变化示意图。
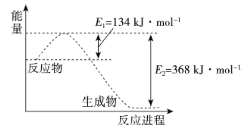
请写出NO2和CO反应的热化学方程式:___。
(2)已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)![]() C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
①升温时,C的反应速率___(填“加快”“减慢”或“不变”)。
②若平衡时,容器容积不变,增大压强,则平衡___。
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)①事实证明,原电池中发生的反应通常是放热的氧化还原反应。利用下列化学反应可以设计成原电池的是___。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=2H2O(l) △H<0
该原电池的负极是通入___(填“氢气”或“氧气”)的一极。
②以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应式为___。
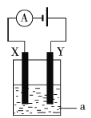
③电解原理在化学工业中有着广泛的应用。如图所示电解池中,a为NaCl溶液,X和Y是两块惰性电极板,则电解时的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据题意,选择恰当的选项用字母代号或文字填空。
(1)中国的高铁技术居于国际领先地位。
①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于___(填字母代号,下同)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是___。
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和___。
a.石灰石 b.粗盐 c.纯碱
④高铁轨道建设铺设的铁轨属于___(填“金属铁”或“铁合金”)。
(2)煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。
①控制燃煤产生的___(填化学式)排放,能够减少硫酸型酸雨的形成。
②煤的气化和液化是实现能源清洁化的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为___。煤的干馏属于__(填“化学变化”或“物理变化”)。
(3)营养均衡有利于身体健康。
①人体内提供能量的主要营养物质为___、糖类和蛋白质。
②维生素是人体需要的营养物质。如图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是___。

③泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和___(填物质名称)反应释放出了气体。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)红热木炭与浓H2SO4反应的化学方程式是C+2H2SO4![]() CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作___(填“氧化剂”或“还原剂”)。
(2)SO2能够使品红溶液褪色,体现了二氧化硫具有___性。
(3)为了探究HClO的漂白性,某同学设计了如下的实验。
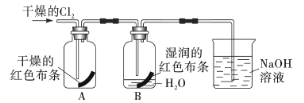
通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是___,从集气瓶B中湿润的红色布条的现象可得出的结论是___,其中发生的反应是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理。
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行:
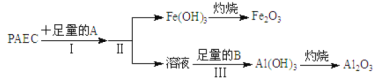
回答下列问题:
①PAFC中铁元素的化合价为__________。
②步骤I中的试剂A是__________ (从氢氧化钠溶液、氨水中选择)步骤III中的试剂B是__________。
③步骤II的操作是__________。
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:
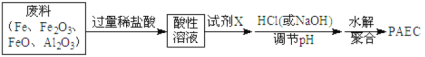
①所得酸性溶液中,不能确定是否一定存在的阳离子是_________(填序号)。
A.Al3+ B.Fe2+ C.Fe3+ D.H+
为证明该离子确实存在,可采用的操作(必须指明所采用的试剂及观察到的现象)是:_____。
②往酸性溶液中加入试剂X的目的是(用离子方程式表示)___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度: A<C<B
D. D点溶液中:c(Cl-)+ 2c(H+)=2c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com