
科目: 来源: 题型:
【题目】一定条件下,有机化合物 Y 可发生重排反应:
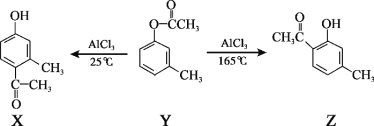
下列说法不正确的是( )
A.X、Y、Z互为同分异构体
B.1 mol X最多能与3 mol H2发生加成反应
C.可以用FeCl3溶液区分Y和Z
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列化学反应的离子方程式,或根据离子方程式,写一个符合条件的化学方程式。
①碳酸镁和足量稀盐酸反应______________________。
②碳酸氢钠与硫酸反应__________________________。
③MnO2+4HCl![]() MnCl2+Cl2↑ +2H2O_____________________。
MnCl2+Cl2↑ +2H2O_____________________。
④Zn+2Ag+=Zn2++2Ag _______________________。
⑤CO32- + 2H+=H2O + CO2↑_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是一种重要的化工原料,可发生如下转化。下列说法中不正确的是( )
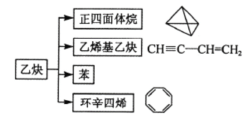
A.以上转化均为加成反应
B.正四面体烷的二氯代物只有1种结构
C.苯乙烯(![]() )和环辛四烯互为同分异构体
)和环辛四烯互为同分异构体
D.等质量的苯和乙烯基乙炔充分燃烧时消耗氧气的量不同
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g)。可以判断该反应已经达到平衡的是
A.2v(NH3)=v(CO2)B.容器中总压强不变
C.容器中混合气体的平均相对分子质量不变D.容器中氨气的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.78 g苯和乙炔的混合物中含有碳氢键数目为6NA
B.100 g 46%的乙醇水溶液中含NA个氧原子
C.2.24 L氯气溶于足量NaOH溶液中,转移电子数为0.1NA
D.1 L 1mol·L-1CH3COONa溶液中醋酸根离子数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组以芳香族化合物A为起始原料,按下列路线合成高血压药物阿替洛尔。
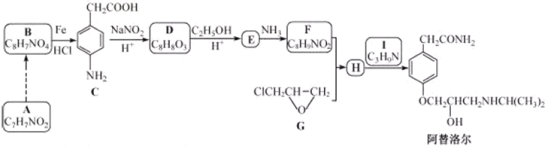
已知:化合物H中除了苯环还有其它环
 :
:![]()
请回答:
(1)下列说法正确的是________。
A.化合物D能发生加成,取代,氧化反应,不发生还原反应
B.化合物E能与![]() 溶液发生显色反应
溶液发生显色反应
C.化合物1具有弱碱性
D.阿替洛尔的分子式是![]()
(2)写出化合物E的结构简式________。
(3)写出![]() 的化学方程式________。
的化学方程式________。
(4)设计从A到B的合成路线(用流程图表示,无机试剂任选)________。
(5)写出化合物C同时符合下列条件的同分异构体的结构简式________。
①![]() 谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
②除了苯环外无其他环。
查看答案和解析>>
科目: 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理”的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的电子排布式是[Ar] __。氮化镓是一种新型材料,可把手机信号放大10倍,氮化镓的功效与电子跃迁有关,而元素的光谱也与电子的跃迁有关。下列变化过程不会产生原子光谱的是__(填字母序号)。
A.[Ar]3d44s2→[Ar]3d54s1
B.![]()
C.![]()
D.![]()
(2)锂离子电池是现代高性能电池的代表,LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为___,P、O、S的第一电离能从大到小的顺序为___。
(3)在硫酸铜溶液中加入过量KCN,可生成配位化合物离子[Cu(CN)4]2-,则1mol[Cu(CN)4]2-中含有的σ键的数目为___;写出一种与CN-互为等电子体的单质的分子式___。
(4)钙和钴都是第四周期元素,且原子的最外层电子数相同,钴的熔沸点远高于钙,其原因是___。
(5)Na2S的晶胞结构如图所示。已知Na+的半径为0.102nm,S2-的半径为0.184nm,则Na2S的晶胞参数a=___cm(列出计算式即可)。
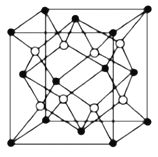
查看答案和解析>>
科目: 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____,孤电子对对数为______, I3-离子的空间构型为___________。
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)下图为碘晶体晶胞结构。有关说法中正确的是_____________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
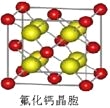
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与![]() 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
A.混合物X中必定含有![]() ,不含
,不含![]()
B.溶液Z中溶质主要是钠盐,且必含![]()
C.灼烧沉淀Y,可能得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com