
科目: 来源: 题型:
【题目】![]() 是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和
是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和![]() 。某小组设计了如下实验装置制备
。某小组设计了如下实验装置制备![]() (夹持及加热仪器略),总反应为
(夹持及加热仪器略),总反应为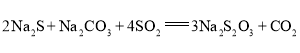 。回答下列问题:
。回答下列问题:
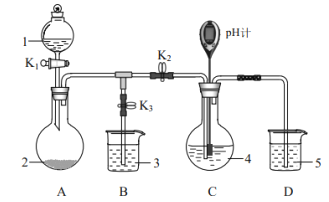
a.![]() b.
b.![]() 粉末 c.
粉末 c.![]() 溶液 d.
溶液 d.![]() 、
、![]() 溶液 e.
溶液 e. ![]() 溶液
溶液
(1)装置A的作用是制备________,反应的化学方程式为________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以 |
打开 | ⅰ.导管口有气泡冒出,② ___ ⅱ. pH计读数逐渐③___ | 反应分步进行:
|
当pH计读数接近7时,立即停止通 | 必须立即停止通 |
(3)![]() 有还原性,可作脱氯剂。向
有还原性,可作脱氯剂。向![]() 溶液中通入少量
溶液中通入少量![]() ,某同学预测
,某同学预测![]() 转变为
转变为![]() ,设计实验验证该预测:取少量反应后的溶液于试管中,________。
,设计实验验证该预测:取少量反应后的溶液于试管中,________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有机物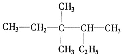 的名称为_____________;
的名称为_____________;
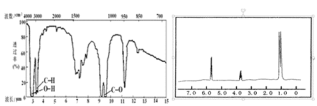
(2)已知某有机物的分子式为C3H8O,红外光谱和核磁共振氢谱如图,氢谱三个峰的面积之比分别为1∶1∶6,写出其结构简式___;
(3)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
①烃A的分子式为__________;
②若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为______;
③若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为_______,_____,_____(任写3种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分析下图的能量变化,确定该反应的热化学方程式书写正确的是( )
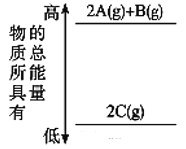
A. 2A(g)+B(g)=2C(g) ΔH<0
B. 2A(g)+B(g)=2C(g) ΔH>0
C. 2A+B=2C ΔH<0
D. 2C=2A+B ΔH<0
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某(NH4)2CO3和(NH4)2SO4的固体混合物含氮量为23.3%。
(1)取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为________________L(保留2位小数)。
(2)向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生进行淀粉的水解实验,操作如下:
(1)取少量淀粉溶液,加入3~5滴稀硫酸,加热几分钟。淀粉水解反应的化学方程式为________________
(2)取少量冷却后的水解液,向其中加入银氨溶液,水浴加热无银镜产生。他由此认为:水解产物中没有葡萄糖。他的结论是否正确?________________,理由是________________
(3)用5t含淀粉80%的粮食,可以制得葡萄糖的质量为______。(假设淀粉的转化率为81%)
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】研究![]() 、
、![]() 、
、![]() 等的处理方法对环境保护有重要意义。
等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成![]() 和
和![]() ,其反应为:
,其反应为:![]()
![]()
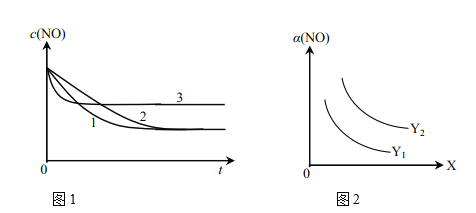
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验温度NO初始浓度O初始浓度催化剂比表面积催化剂用量编号(℃)
实验 编号 | 温度 (℃) | NO初始浓度
| CO初始浓度
| 催化剂比表面积
| 催化剂用量 (g) |
Ⅰ | 280 |
|
| 82 | 50 |
Ⅱ | 280 |
|
| 124 | 50 |
Ⅲ | 350 |
|
| 124 | 50 |
②图2表示NO的平衡转化率(a)随温度、压强变化的示意图。X表示的是________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应
以体积比1:2置于密闭容器中发生反应![]() ,达到平衡时
,达到平衡时![]() 的体积分数为25%。该反应的平衡常数
的体积分数为25%。该反应的平衡常数![]() ________。
________。
(3)利用原电池反应可实现![]() 的无害化,总反应为
的无害化,总反应为 ,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com