
科目: 来源: 题型:
【题目】Ⅰ.常温下,浓度均为0.1 mol·L-1的六种溶液的pH如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
请回答下列问题:
(1)上述六种溶液中,水的电离程度最小的是________(填化学式)。
(2)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是_____(填写一种物质即可)。
Ⅱ.常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示:
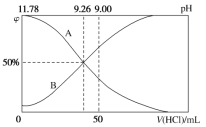
(3)根据图象回答下列问题。
①表示NH3·H2O浓度变化的曲线是__________(填“A”或“B”)。
②NH3·H2O的电离常数为______________。
③当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=______ mol·L-1(用数字计算式表示)。
Ⅲ.已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(4)称取2.000 g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有________。
(5)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为____________。终点时消耗标准溶液25mL,硝酸银样品纯度为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+ H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是 ( )
CO(g)+ H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是 ( )
A.增加H2O的物质的量浓度B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 均为短周期主族元素,
均为短周期主族元素,![]() 、
、![]() 处于同一周期,
处于同一周期,![]() 、
、![]() 的最低价离子分别为
的最低价离子分别为![]() 和
和![]() ,
,![]() 和
和![]() 具有相同的电子层结构。下列说法正确的是( )
具有相同的电子层结构。下列说法正确的是( )
A.原子的最外层电子数:![]()
B.阴离子还原性:![]()
C.离子半径:![]()
D.原子序数:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和硫的氧化物的综合利用是目前研究的热点之一。已知:
i.N2(g)+O2(g)=2NO(g) △H=+180.0 kJ·mol-1
ii.2SO2(g)+O2(g)=2SO3(g) △H=-196.6 kJ·mol-1
iii.2NO(g)+O2(g)=2NO2(g) △H=-113.0 kJ·mol-1
(1)反应iV:2NO2(g)+2SO2(g)=2SO3(g)+N2(g)+O2(g)的 △H=________;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是______(填选项字母)。
A 缩小容器容积 B 再充入SO2 C 降低温度 D 分离出SO3
(2)T1°C时,容积相等的密闭容器中分别充入NO2和SO2的混合气体4 mol,发生反应iV。NO2或SO2的平衡转化率(a)与起始充入的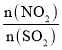 关系如图1所示。
关系如图1所示。
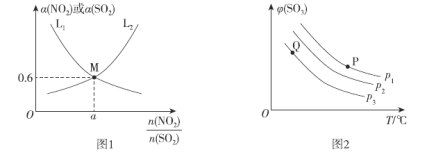
①图中能表示平衡时a(SO2)与起始充入的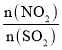 关系的曲线为_____(填“L1”或“L2”)。
关系的曲线为_____(填“L1”或“L2”)。
②反应的平衡常数K=________。
(3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。
①P1、P2 、P3由大到小的顺序为__________。
②P、Q两点对应状态下,单位体积内反应物活化分子数目:P__________Q(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
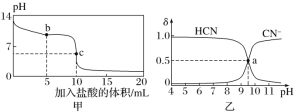
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.用排饱和氯化铵溶液的方法收集氨气
C.金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,不可用泡沫灭火器灭火
D.在4mL0.1mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液颜色从橙色变成黄色
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
A. 平衡向正反应方向移动了 B. 平衡向逆反应方向移动了
C. 物质B的质量分数减小了 D. a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】Al及其化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A [Ne]3s1 B [Ne]3s2 C [Ne]3s23p1 D [Ne] 3s13p2
(2)熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_____(标出配位键);其中Al的配位数为_________。二聚体A12C16中Al原子的轨道杂化类型是________。
(3) 实际上,偏铝酸钠在水溶液中都是以Na[Al(OH)4]和形式存在,1mol Na[Al(OH)4]中含有σ键的数目为_________。
(4)Ga(镓)和铝是同一主族元素,Ga原子的电子排布式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以磷石膏(主要成分是CaSO4,含少量的Al2O3、SiO2等杂质)为原料制备Na2SO4、CaBr2·2H2O和NH4Cl等产品的工艺流程如下:
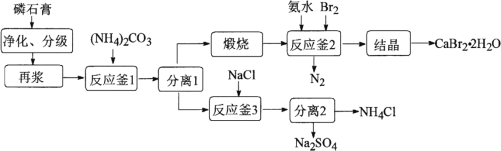
请回答:
(1) 反应釜1中![]() 的浸出率与加料速度、反应温度的关系如下图所示:
的浸出率与加料速度、反应温度的关系如下图所示:
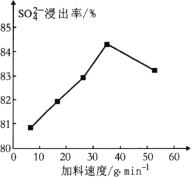
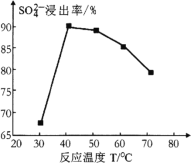
①反应的最佳条件为________。
②其它条件相同时,![]() 浸出率随反应温度先升后降的原因是________。
浸出率随反应温度先升后降的原因是________。
(2) 实验室里模拟上述煅烧操作,下列仪器中有用到的是________。
A 瓷坩埚 B 铁坩埚
C 酒精灯 D 酒精喷灯
(3) 反应釜2中进行的反应是________。
(4) 反应釜3中完成反应后,分离硫酸钠、氯化铵的操作:在90℃左右蒸发浓缩至较多晶体析出→________得到Na2SO4粗品;同时,将热滤液________→得NH4Cl粗品(Na2SO4、NH4Cl的溶解度如图所示)。
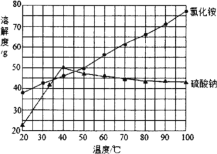
查看答案和解析>>
科目: 来源: 题型:
【题目】关于盐类水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2S水解的离子方程式为:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com