
科目: 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑,若氧化产物比还原产物多1.75 mol,则下列判断正确的是( )
A.生成42.0 L N2(标准状况)B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为2.5 molD.被氧化的N原子的物质的量为3.75 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下向20 mL 0.1mol/LCH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )
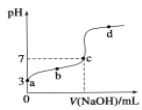
A. a点表示的溶液中c(CH3COO-)略小于10-3 mol/L
B. c点表示CH3COOH和NaOH恰好完全中和
C. b点表示的溶液中c(CH3COO-)>c(Na+)
D. 滴定过程中溶液中的n (CH3COO-) +n(CH3COOH)的和不变
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法正确的是
A.12g![]() 的原子核内中子数为6NA
的原子核内中子数为6NA
B.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
C.25℃时,1LpH=2的H2C2O4溶液中含H+的数目为0.02NA
D.标准状况下,2.24LCO2与足量Na2O2反应转移的电子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是

A. 若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B. 若X为铜棒,开关K置于N处可以加快铁的腐蚀
C. 若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D. 若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
B. 苯甲酸的结构简式为![]()
C. 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车
D. C5H10的同分异构体中属于烯烃的有6种
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O64-。试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少______。
(2)滴定操作时,左手控制滴定管,右手_______,眼睛要注视________。
(3)滴定(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由_______色变为_______色。
(4)水中溶解氧的计算式是___(以g/L为单位)。
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果____(填“偏高”、“偏低”或“无影响”,下同)。
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500℃下发生的催化氧化反应2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果该反应在密闭容器中进行,则下列有关说法错误的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.达到化学平衡状态时,2v正(SO2)=v逆(O2)
C.为了提高SO2的转化率,可适当提高O2的浓度
D.在上述条件下,SO2不可能100%地转化为SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】钒被称为“工业味精”“工业维生素”,在发展现代工业、国防等方面发挥着至关重要的作用。某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒铬的工艺流程如下:

回答下列问题:
(1)“焙烧”时会生成NaVO3和Na2CrO4,生成Na2CrO4的化学方程式是_________。
(2)滤渣1中主要含_______。滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于_____。(常温下,当溶液中离子浓度小于1×10-6mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)
(3)“沉钒”所用0.1mol/L (NH4)2SO4溶液中,离子浓度由大到小的顺序是_______。
(4)“还原”时溶液的pH在2.5左右,此时控制酸度应选用_______(填标号)。
A.稀盐酸 B.稀硫酸 C.稀硝酸 D.硫酸铵
(5)NH4VO3、Cr(OH)3煅烧时发生反应的类型是否相同?___________。
(6)工业上可用电解还原法处理含Cr2O72- 的酸性废水。用铁板作阳极,电解过程中,废水pH逐渐上升,Cr3+、Fe3+都以氢氧化物沉淀析出,达到废水净化的目的。
①其中阳极的电极反应式是___________。
②电解过程中,废水pH上升的原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com