
科目: 来源: 题型:
【题目】氢气作为新能源,广泛应用于能源、化学等领域。现阶段氢气主要通过天然气重整的方式进行工业生产。发生的化学方程式如下:
反应I CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206 kJ/mol
CO(g)+3H2(g) △H1=+206 kJ/mol
反应II CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41 kJ/mol
CO2(g)+H2(g) △H2=-41 kJ/mol
副反应 CH4(g)![]() C(s)+2H2(g) △H3=+75 kJ/mol
C(s)+2H2(g) △H3=+75 kJ/mol
(1)①若仅发生反应I,为提高CH4的平衡转化率,宜采用的反应条件为_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②某研究小组在一定条件下往恒温恒容的密闭容器中通入一定量的甲烷和水蒸气,实验过程中发现CO2的产率远大于CO的产率,请解释可能的原因________________。
(2)在实际生产过程中,科学家发现使用Ni作为催化剂(当Ni表面吸附大量碳时,会导致催化剂活性下降),可加快反应I的反应速率,从而加快整个反应的进行,提高单位时间内H2的产率。
①某恒容体系中,压强为1.3MPa,水/甲烷的物质的量之比为4,反应相同时间,H2的物质的量随反应温度的变化曲线如图所示。
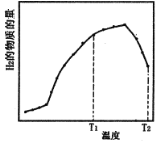
下列说法正确的是__________
A.对反应I而言,KT1>KT2
B.水/甲烷的物质的量之比等于4,大于初始反应的化学计量数之比,有利于促进CH4的转化,同时也有利于CO转化为CO2
C.使用Ni做催化剂,可增加活化分子百分数,从而加快反应速率,其主要原因是提高分子自身所具有的能量
D.若控制其他条件不变,缩小体积,则CH4的平衡转化率将减小
②在某恒温体系中,体积为1L,水/甲烷的物质的量之比等于4,投入CH4的量为l mol,若仅发生上述一系列反应,一段时间后,测得CH4的转化率为a,其中生成CO的选择性(转化的CH4中,生成CO的百分含量)为b,CO2的浓度为c mol/L,求此时H2的物质的量浓度为___________,CO的物质的量浓度为______________
(3)现科学家发现,以Ni-CaO为复合催化剂能在一定程度上促进天然气重整反应的正向进行,使H2体积分数达到95%左右。请从能量利用及平衡移动角度,理论分析以Ni-CaO为复合催化剂的优点_____________________________________________。
(4)CH4自身也可做为然料电池的原料,其工作原理如图所示。
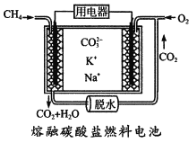
请写出通入甲烷-极的电极反应式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】PHB塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为![]() ,下面有关PHB的说法不正确的是( )
,下面有关PHB的说法不正确的是( )
A.PHB通过加聚反应制得
B.PHB的单体是CH3CH2CH(OH)COOH
C.PHB在微生物作用下的降解产物可能有CO2和H2O
D.PHB是一种聚酯
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
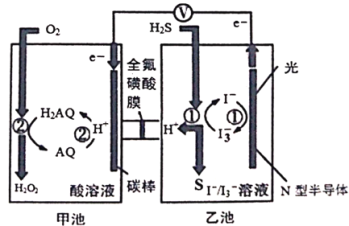
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,盐酸和硫酸的混合溶液20 mL,向混合物中逐滴加入0.05 mol/L Ba(OH)2溶液,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法不正确的是
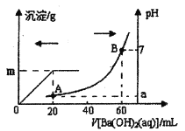
A.原混合液中盐酸物质的量浓度为0.2 mol/L
B.逐滴加入Ba(OH)2溶液,当体积为40 mL,此时发生的离子方程式:OH-+H+=H2O
C.生成沉淀的最大质量m=2.33g
D.现将上述20 mL酸混合溶液与60 mL Ba(OH)2溶液直接混合,发生的离子方程式:Ba2++6OH-+SO42-+6H+=BaSO4↓+6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于化工等行业,其难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如图所示:

下列说法正确的是
A.步骤①,为加快海绵铜的溶解速度,可将其进行适当粉碎并用大火持续加热
B.步骤③主要离子方程式:H2O+2Cu2++SO32-+2Cl-=CuCl↓+SO42-+2H+
C.步骤⑤包括用pH=2的酸洗、水洗两步操作,为了防止CuCl被氧化,故不采用硝酸,而应采用硫酸或盐酸
D.步骤⑥中醇洗主要目的是去除CuCl表面水分,但在步骤⑦中仍需要烘干,故节约成本可删除醇洗操作
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案设计及结论均正确的是( )
A.淀粉溶液![]() 水解液
水解液![]() 为蓝。结论:淀粉完全没有水解
为蓝。结论:淀粉完全没有水解
B.淀粉溶液![]() 水解液
水解液![]() 无砖红色沉淀。结论:淀粉完全水解
无砖红色沉淀。结论:淀粉完全水解
C.淀粉溶液![]() 水解液
水解液![]() 中和液
中和液![]() 有砖红色沉淀。结论:淀粉已水解
有砖红色沉淀。结论:淀粉已水解
D.淀粉溶液![]() 水解液
水解液![]() 无现象。结论:淀粉没有水解
无现象。结论:淀粉没有水解
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:
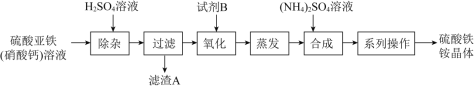
下列说法不正确的是![]()
![]()
A.滤渣A的主要成分是![]()
B.“系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
C.相同条件下,![]() 溶解度
溶解度![]() e2(SO4)3小
e2(SO4)3小
D.“氧化”反应中试剂B可选NaClO
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的非金属性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组发现有机化合物A的结构如图所示:
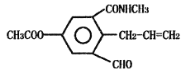
下列有关化合物A说法正确的是
A.化合物A的分子式为C14H13NO4
B.向化合物A中加入少量溴水,观察到溴水褪色,证明化合物A中含碳碳双键
C.1 mol化合物A最多可与3 mol NaOH溶液发生反应
D.化合物A可发生加成、氧化、缩聚、取代等反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列3种不同粒子![]() H、
H、![]() H、
H、![]() H表示______种元素,______种核素,
H表示______种元素,______种核素,![]() H、
H、![]() H、
H、![]() H互称为__________________。
H互称为__________________。
(2)有人称煤炭是“工业的粮食”,通过煤的综合利用可以获得重要化工原料,如焦炭,它是煤的______ (填“蒸馏”或“干馏”)产物,可用于________________ (填出一种用途);以煤为原料可以制得水煤气,其反应的化学方程式为________________________________。
(3)元素的电负性的大小可以作为判断元素金属性与非金属性强弱的尺度。下表列出部分短周期元素的电负性。请回答下列问题。
元素 | Al | B | Be | C | Cl | X | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Y | O | P | S | Si |
电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
①根据上表给出的数据,可知元素的电负性越大,____________(填“金属性”或“非金属性”)越强。
②推测Y 为______(填元素符号),用电子式表示X元素与Y元素的化合物的形成过程__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com