
科目: 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为 2SnO2+3C![]() 2Sn+a M↑+CO2↑,则下列说法中错误的是
2Sn+a M↑+CO2↑,则下列说法中错误的是
A.a 的值为 2B.反应中 SnO2 被还原
C.每生成 1 mol M 转移电子 8 molD.反应后只有一种氧化产物
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1000 mol·L-1的NaOH溶液与25.00 mL 0.1000 mol·L-1HA(-元酸)溶液进行滴定实验,得到滴定曲线(如图所示),下列说法不正确的是
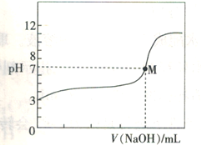
A.HA为-元弱酸
B.常温下,HA的电离平衡常数Ka=10-5
C.M点时溶液的pH=7,此时加入的V(NaOH)<25.00 mL
D.可选用甲基橙作指示剂,到达滴定终点时溶液由红色变为黄色
查看答案和解析>>
科目: 来源: 题型:
【题目】饱和BaCO3溶液中存在平衡:BaCO3(s)![]() Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
A.加入少量0.1 mol·L-1盐酸B.加入少量硝酸钡固体
C.加入少量0.1 mol·L-1硫酸D.加入少量氢氧化钡固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定化学用语正确的是
A.NaHS水解的离子方程式:HS-+H2O=S2-+H3O+
B.Ba(OH)2的电离方程式:Ba(OH)2![]() Ba2++2OH-
Ba2++2OH-
C.NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO42-
D.Na2S水解的离子方程式:S2-+2H2O=H2S+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向恒容的密闭容器中充入一定量的NO2(g),发生反应2NO2(g)![]() N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
A.混合气体的平均相对分子质量B.NO2(g)的百分含量
C.容器内压强D.NO2和N2O4的反应速率之比
查看答案和解析>>
科目: 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表一个恒温容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计),其中能表示氢气和氦气在容器中的相对关系的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,一定量混合气体发生反应xA(g)+yB(g)![]() pC(g)+qD(g),平衡时测得B的浓度为1.0 mol·L-1。保持温度不变,将容器的体积压缩到原来的一半,再次达到平衡时,测得B的浓度为1.5 mol·L-1。下列有关判断正确的是
pC(g)+qD(g),平衡时测得B的浓度为1.0 mol·L-1。保持温度不变,将容器的体积压缩到原来的一半,再次达到平衡时,测得B的浓度为1.5 mol·L-1。下列有关判断正确的是
A.x+y<p+qB.气体的平均摩尔质量增大
C.压缩体积时,平衡向逆反应方向移动D.体系中混合气体的平均密度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A、B、C互为同分异构体,分子式均为![]() ,有关的转化关系如下图所示。
,有关的转化关系如下图所示。
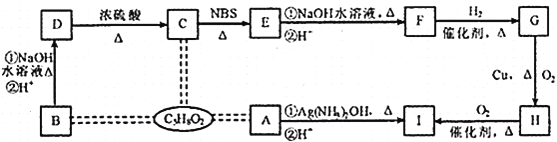
已知:![]() 的碳链无支链,且
的碳链无支链,且![]() A能与足量
A能与足量![]() 完全反应可得到
完全反应可得到![]() 单质Ag;
单质Ag;
![]() 为含有一个五环的酯;
为含有一个五环的酯;
![]() CH3—CH=CH—R
CH3—CH=CH—R![]() Br—CH2—CH=CH—R
Br—CH2—CH=CH—R
请回答下列问题:
![]() 中所含官能团的名称是 ______ 。
中所含官能团的名称是 ______ 。
![]() 、H的结构简式依次为 ______ 、 ______ 。
、H的结构简式依次为 ______ 、 ______ 。
![]() 的加聚反应产物的结构简式为 ______ 。
的加聚反应产物的结构简式为 ______ 。
![]() 不能发生反应的反应类型有 ______
不能发生反应的反应类型有 ______ ![]() 填序号
填序号![]() 。
。
![]() 取代反应
取代反应![]() 加成反应
加成反应![]() 银镜反应
银镜反应![]() 水解反应
水解反应![]() 消去反应
消去反应 ![]() 聚合反应
聚合反应![]() 氧化反应
氧化反应![]() 还原反应
还原反应![]() 皂化反应
皂化反应![]() 酯化反应
酯化反应
![]() 写出
写出![]() 的反应方程式: ______
的反应方程式: ______ ![]() 只写
只写![]() 条件下的反应,有机物用结构简式表示
条件下的反应,有机物用结构简式表示![]() 。
。
![]() 是D的同分异构体,且符合以下条件:
是D的同分异构体,且符合以下条件:
![]() 分子中只含有一个甲基
分子中只含有一个甲基![]() ;
;
![]() 能发生银镜反应;
能发生银镜反应;
![]() M与足量Na反应能产生标准状况下
M与足量Na反应能产生标准状况下![]() 的气体;
的气体;
![]() 除官能团上的氢原子外,还有两种不同类型的氢原子。
除官能团上的氢原子外,还有两种不同类型的氢原子。
请任意写出一种符合条件的M的结构简式: ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热测定。

(1)写出该反应的热化学方程式[生成1mol H2O(l)时的反应热为-57.3 kJ·mol-1]________________________。
(2)取50mLNaOH溶液和30 mL硫酸溶液进行实验。
①实验数据如下表,温度差平均值为_________
温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则生成1 mol H2O(l)时的反应热ΔH=_____(列出计算式即可,单位为kJ·mol-1)。
③上述实验数值结果大于-57.3 kJ·mol-1,产生偏差的原因不可能是_____
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com