
科目: 来源: 题型:
【题目】按要求回答下列问题。
I.五种元素的原子电子层结构如下:A:1s22s22p63s23p63d54s2、B:1s22s22p63s2、C:1s22s22p6、D:1s22s22p63s23p2、E:[Ar]4s1。
请回答:(填元素符号)
(1)________元素是稀有气体。含未成对电子数最多的元素是________。
(2)A元素原子的核外电子共有________种运动状态,能量最高的能级是________(填能级符号)。
(3)D元素原子的价层电子排布图是________。
(4)________元素的电负性最大,________元素原子的第一电离能最大,________元素最可能生成具有催化性质的氧化物。
II.Q、R、X、Y、Z五种元素的原子序数依次递增,除Z以外,其余的均为短周期主族元素。已知:
①Q原子2p能级上有一个空轨道;
②R原子核外L层电子数为奇数;
③X原子2p轨道上只有一对自旋相反的电子;
④Y原子价电子(外围电子)排布msnmpn;
⑤Z原子M层所有轨道全部充满,N层无成对电子,只有1个未成对电子。请回答下列问题:
(5)Z2+的核外电子排布式是________,X元素基态原子的核外电子排布图是____________。
(6)Q与Y分别形成的最简单气态氢化物中,稳定性更强的是________(填化学式)。
(7)Q、R、X、Y三种元素的第一电离能数值由大到小的顺序为________(用元素符号作答)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体分别在等浓度的氯化钾和氯化钙溶液中的溶解度是相同的
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
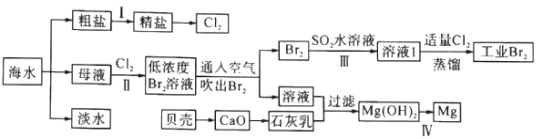
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中依次加入过量BaCl2、Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_____________。
(2)海水提溴,制得1mol Br2至少需要消耗_________mol Cl2。步骤Ⅱ中需要向母液中加入稀硫酸酸化,其作用是_________________。步骤Ⅱ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为__________。
(3)为了从工业Br2中提纯溴,除去产物中残留的少量Cl2,可向其中加入_________溶液。
(4)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是_________(填序号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)判断Mg(OH)2是否洗涤干净的操作是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为确定由硝酸银和硝酸钠组成的混合物中硝酸银的含量,实验室可采用多种方法测定。现取两份不同质量的该混合物进行如下实验:
I.方法一:采用“佛尔哈德法”测定。“佛尔哈德法”可用于测定含银离子的硝酸溶液中银离子的含量,该方法是以铁铵钒[FeNH4(SO4)2·12H2O]为指示剂,NH4SCN溶液为标准溶液。从滴定开始到滴定终点,溶液中发生的主要反应有:
①Ag+(aq)+SCN-(aq)=AgSCN(s)(白色)
②Fe3++SCN-=Fe(SCN)2+(红色)
取14.0 g该混合物溶于蒸馏水配成500 mL待测溶液。取出25.00 mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50 mL滴入指示剂铁铵钒溶液,用0.1000 mol·L-1的NH4SCN标准溶液滴定,消耗标准溶液35.00 mL。
(1)该滴定不能在中性或碱性条件下进行是因为Fe3+会转化为_________(填化学式,下同),Ag+会转化为___________。
(2)当滴入25.00 mL标准溶液时,锥形瓶中_________(填“有”或“没有”)沉淀生成。
(3)滴定终点溶液颜色的变化为________。
(4)称量混合物时,砝码生锈(锈迹未脱落)会导致测得的硝酸银的含量________(填“偏高”或“偏低”或“无影响”)。
(5)该混合物中硝酸银的质量分数为___________(保留三位有效数字)。
II.方法二:取m g该混合物溶于水配成500 mL溶液,取出50.00 mL溶液于锥形瓶中加入过量的稀盐酸充分反应,经“一系列操作”可得到纯净干燥的AgCl固体2.87 g。根据要求回答下列问题:
(6)“一系列操作”的具体步骤为__________、低温干燥。
(7)该混合物质量m=____________(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
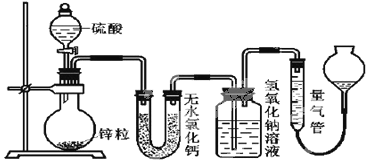
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡金属元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的名称:A__________,C________。
(2)E元素原子的未成对电子数是________,E元素在周期表中位于第________周期______族;已知元素周期表可按电子排布分为s区、p区、d区等,则E元素在______区。
(3)画出D的核外电子排布图:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,则Na2A溶液中各离子的浓度大小关系为______________。
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)<c(B-)。
①混合溶液中c(B-)________(填“>”“<”或“=”)c(HB)。
②混合溶液中c(HB)+c(B-)________(填“>”“<”或“=”)2c(Na+)。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
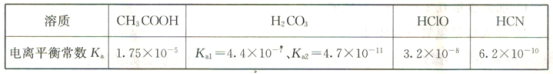
①同物质的量浓度的CH3COONa、NaClO、NaCN溶液中阴离子(不含OH-)浓度大小关系为____________。
②同pH的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是________(填字母)。
a HCN b HClO c H2CO3 d CH3COOH
③常温下物质的量浓度相同的醋酸和醋酸钠混合液的pOH=8,则c(CH3COO-)-c(CH3COOH)=____________(用数值列出计算式即可) mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),回答下列问题:
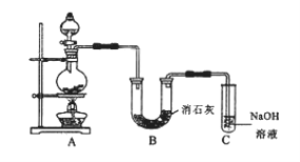
(1)在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,写出反应的化学方程式____;
(2)C装置的作用是____。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是____。
②另一个副反应是2HCl+Ca(OH)2=CaCl2+2H2O,为避免此副反应的发生,可将装置如何改进____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com