
科目: 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
实验步骤 | 实验现象 | 实验结论及离子反应方程式 |
| 甲:___ 乙:___ | 离子反应方程式 甲:___ 乙:___ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
评价:甲同学设计的实验方案的合理性是___(填序号)
A.非常合理 B.完全不合理 C.部分合理
补充和完善:上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:___。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
(金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是___。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向___,写出电极反应式。电极反应式:____、____。
装置图
查看答案和解析>>
科目: 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
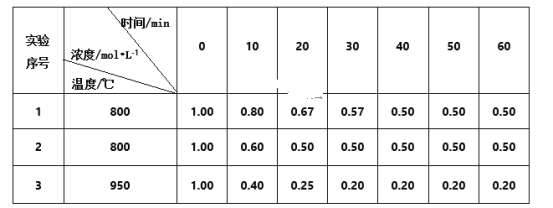
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为___mol·L-1·min-l,50min时,v正___v逆(填“<”“>”或“=”)。
(2)0~20min内,实验2比实验1的反应速率___(填“快”或“慢”),其原因可能是___。
(3)实验3比实验1的反应速率__(填“快”或“慢”),其原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
化学键 | H-C | C=C | H-O | C-O | C-C |
键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
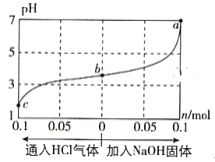
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】水晶石是生产玻璃的原料,工业上回收水晶石废料(主要含SiO2,还含有CeO2、CaO、MgO、Na2O等)中的SiO2并富集稀土元素Ce(铈)元素的一种流程如下:

已知CeO2不溶于水,微溶于稀酸。
⑴玻璃工业上用SiO2、Na2CO3和CaCO3在高温下反应制普通玻璃(Na2O·CaO·6SiO2)的化学方程式为_______。
⑵“还原”时发生反应的离子方程式为______。
⑶“还原”时稀硫酸应适当过量,目的除保证反应充分进行及加快反应速率外,还有______。还原时控制其他条件一定,只改变反应的温度,所得SiO2产品的纯度如右图所示。超过70℃所得SiO2产品纯度下降的原因是_______。

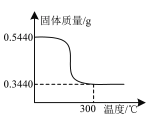
⑷洗涤SiO2的方法是_______。
⑸向Ce2(SO4)3溶液中加入H2C2O4会析出Ce2(C2O4)3·10H2O晶体,将0.5440g Ce2(C2O4)3在N2气流中加热,所得残余固体的质量随温度的变化如图所示。已知加热时生成三种氧化物,写出Ce2(C2O4)3固体加热到300℃时反应的方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,请用化学符号回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___。
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是___,最高价氧化物的水化物中酸性最强的是___。
(3)第三周期元素形成的简单离子中半径最小的微粒是___,写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式___、___。
(4)元素③的氢化物的电子式是___;该氢化物与元素⑩的氢化物发生反应的化学方程式___。
(5)用电子式分别写出元素⑨与元素②、⑥形成化合物过程___、___。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )
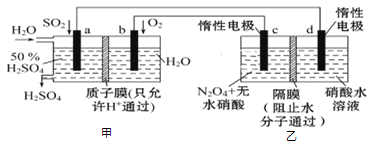
A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 电解后乙装置d电极附近溶液的pH不变
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 甲中每消耗1mol SO2,乙装置中有1mol H+通过隔膜
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置能达到实验目的的是
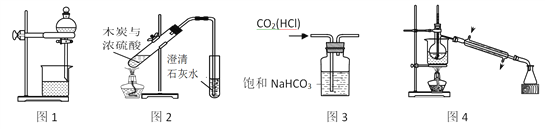
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表中前四周期元素,且原子序数依次增大,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其他能层均已充满电子。
(1)写出基态E原子的价电子排布式_______。
(2)A与C可形成CA3分子,该分子中C原子的杂化类型为______,该分子的立体结构为_____;C的单质与BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式______;A2D由液态形成晶体时密度减小,其主要原因是__________(用文字叙述)。
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为___;若相邻D原子和F原子间的距离为a cm,阿伏加德罗常数的值为![]() NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。
NA,则该晶体的密度为______g·cm-3(用含a、NA的式子表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com