
科目: 来源: 题型:
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2RCHO+O2![]() 2RCOOH。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
2RCOOH。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
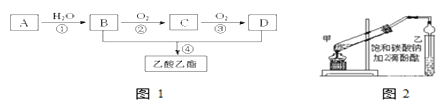
(1)B、D分子内含有的官能团分别是____、______(填名称)。
(2)写出下列反应的反应类型:①______,④________。
(3)B→C的反应方程式为____________
(4)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取的主要步骤如下:
①在甲试管(如图2)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出有机层、洗涤、干燥。
a.若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:______,此装置中采用了球形干燥管,其作用是_________。
b.欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是_____;分离时,乙酸乙酯应该从仪器____(填:“下口放” 或“上口倒”)出。
c.生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)______。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将![]() 体积NO和
体积NO和![]() 体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留
体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留![]() 体积的气体,该气体与空气接触变为红棕色,则
体积的气体,该气体与空气接触变为红棕色,则![]() 为( )
为( )
A. 3:2 B. 2:3 C. 8:3 D. 3:8
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
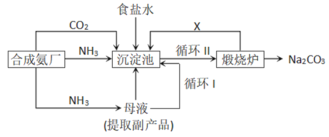
(1)实验室制取氨气的反应方程式为______
(2)上述生产纯碱过程副产品是______。
(3)沉淀池中发生的化学反应方程式是______。
(4)写出上述流程中X物质的电子式______。
(5)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(选填循环Ⅰ或循环Ⅱ)的循环。从沉淀池中取出沉淀的操作是_________。
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知以下物质为铁及其化合物之间的相互转化:

试回答:
(1)写出D的化学式___,H的化学式___。
(2)鉴别G溶液的试剂为___。
(3)写出由E转变成F的化学方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NOx之间的转化具有重要意义。
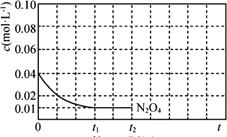
(1)已知:N2O4(g) ![]() 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变 D.容器内气体的密度不变 E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
2NO2(g)的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线________。
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
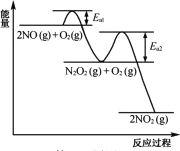
Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因____。

查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物具有广泛的应用。回答下列问题:
(1)CuSO4中阳离子的基态核外电子排布式为________。
(2)S、O、N三种元素的第一电离能由小到大的顺序为_________(填元素符号)。
(3)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2,其中NH3的空间构型为____。
(4)[Cu(NH3)4](NO3)2属于_____晶体。
(5)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1 mol CN-中含有的π键数目为____。
(6)已知Cu2O晶胞结构如图所示,该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数代表_____原子(填元素符号)。
)。则D原子的坐标参数代表_____原子(填元素符号)。
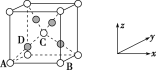
(7)金属铜的晶体晶胞中Cu原子的空间利用率是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________。
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成,丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉。羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3的空间构型为_______;
(5)“NiO”晶胞如图:
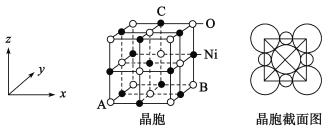
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________;
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)。(Ni的相对于原子质量是59)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2某些性质的装置图。已知SO2具有:A.酸性、B.氧化性、C.还原性、D.漂白性。
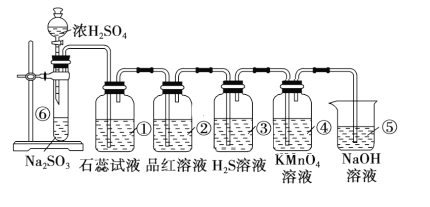
试回答:
(1)①中的现象为__,证明SO2具有__性(请填字母);
(2)②中的品红溶液__,证明SO2有__性(请填字母);
(3)④中的现象是__,证明SO2有__性(请填字母);
(4)⑤的作用是___,试写出该反应的离子反应方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶A和盛有潮湿有色布条的广口瓶B,可观察到的现象是__,发生该现象的原因___。(试用离子方程式和简单文字解释)
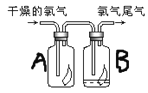
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用__溶液吸收多余的氯气,原理是___(用化学方程式表示)。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__(填化学式),长期露置于空气中的漂白粉会变质,变质后的漂白粉加稀盐酸后产生的气体是__(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
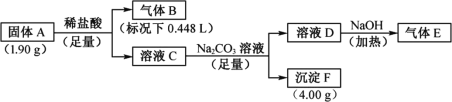
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件下可生成乌洛托品(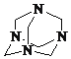 学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:
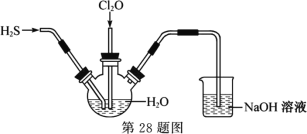
请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________。
(2) 若通入水中的Cl2O已过量,设计实验方案检验________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com