
科目: 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是________,光导纤维的主要成分是________。(填化学式)
(2)工艺师常用氢氟酸来雕刻玻璃,发生反应的化学方程式为_________。
(3)玉石的主要成分基本都属于硅酸盐,翡翠的主要成分为NaAlSi2O6,用氧化物形式表示为________。
(4)高纯度单晶硅可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
写出步骤①的化学方程式: _______。
步骤②的产物经过冷凝后得到的SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点57.6 ℃),提纯SiHCl3主要操作的名称是________。
步骤③需要在无水无氧环境下进行,若在有氧环境下,除了有不安全因素外,还可能使产品中混有杂质________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
(1)氨气的电子式为___,它的共价键属于___(填“极性”或“非极性”)键,其溶于水显碱性的理由是(用化学方程式表示)___。
(2)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且一定使平衡混合物中NH3的体积分数增大的是___。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(3)常温下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
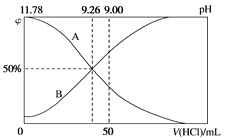
表示NH3·H2O浓度变化的曲线是___(填“A”或“B”)。
(4)当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=___mol/L(用数字表示)。若液氨中也存在类似水的电离(H2O+H2O![]() H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O++OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
①写出液氨的电离方程式:___。
②写出碳酸钠溶于液氨后第一级氨解的离子方程式:___。
③写出碳酸钠的液氨溶液中各离子浓度的大小关系:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是( )
A.陶瓷、玻璃、水泥容器都能贮存氢氟酸
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在具有磨口玻璃塞的试剂瓶中
C.用![]() 制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过
制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通过![]()
D.由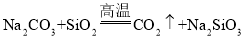 可知,硅酸的酸性强于碳酸
可知,硅酸的酸性强于碳酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确; Cl2过量,Fe2+、I-均被氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++2HCO | 正确;Mg(OH)2比MgCO3更难溶 |
C | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO | 正确;H2SO3的酸性强于HClO |
D | 将Na2O2固体溶于水:2Na2O2+2H2O=4Na++4OH-+O2↑ | 正确; Na2O2是碱性氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含有少量SiO2、FeO·xFe2O3等杂质)制取铝的一种工艺流程示意图如下:
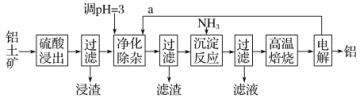
已知:生成氢氧化物沉淀的pH如下表。
沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH | 3.2 | 5.2 | 12.4 |
(1)为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_______________
(2)浸渣的主要成分为____________________
(3)净化除杂操作分为两步:第一步是通入气体a,其目的是_____________________。第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化除杂生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________
(4)写出沉淀反应操作中发生反应的离子方程式:________________________。
(5)实验室高温焙烧时,用于盛放固体的仪器名称是_______________。
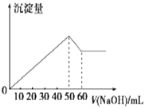
(6)在AlCl3和MgCl2的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原溶液中AlCl3和MgCl2的物质的量之比为__________,并写出加入NaOH溶液的体积为50-60mL时的化学反应方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室欲配制0.1 mol/L的NaOH溶液450 ml,下列说法正确的是( )
A.用托盘天平称量固体的质量为1.8 g
B.称量NaOH固体时可在烧杯中进行
C.定容时仰视读数所得溶液的浓度偏大
D.当液面在刻度线下2-3 mm时,换用胶头滴管滴加蒸馏水定容
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是
A.若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大
B.若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动
C.若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色
D.若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是____。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是____。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。某同学设计了从该污水中回收纯净的金属铜的方案。

在能制得纯铜的方案中,哪一步操作会导致环境污染?___。应增加哪些措施防止污染______。
查看答案和解析>>
科目: 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
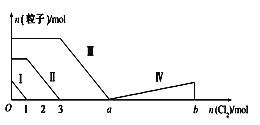
A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是
A.灼烧海带
B.将海带灰溶解后分离出不溶性杂质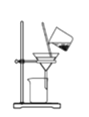
C.制备Cl2,并将I-氧化为I2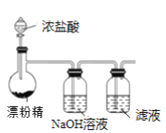
D.以淀粉为指示剂,用Na2SO3标准溶液滴定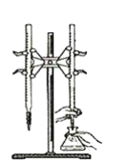
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com