
科目: 来源: 题型:
【题目】燃烧1g乙炔(C2H2)生成二氧化碳和液态水,放出热量50kJ, 则这一反应的热化学反应方程式为( )
A. 2C2H2(g)+ 5O2(g) ═4CO2(g)+ 2H2O(l) ΔH= +50kJ/mol
B. C2H2(g)+ 5/2O2(g)═2CO2(g)+ H2O(l) ΔH= +1300kJ/mol
C. 2C2H2+ 5O2═4CO2+ 2H2O ΔH=-2600kJ
D. 2C2H2(g)+ 5O2(g)═4CO2(g)+ 2H2O(l) ΔH=-2600kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。
请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为___,在![]() =1的条件下,为更好的除去NOx,应控制的最佳温度在___K左右。
=1的条件下,为更好的除去NOx,应控制的最佳温度在___K左右。

(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度(℃) | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式:___。
②若T1<T2,则该反应的Q__0(填“>”“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
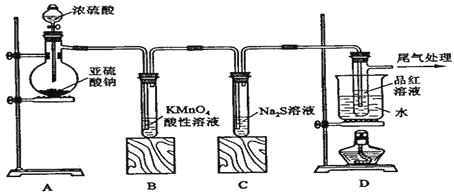
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达为:K=![]() 。
。
根据题意完成下列填空:
(1)写出该反应的化学方程式___;若温度升高,K增大,该反应是___反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是___(选填编号)。
a.v正(H2O)=v逆(H2) b.容器中气体的相对分子质量不随时间改变
c.消耗nmol H2同时消耗nmolCO d.容器中物质的总物质的量不随时间改变
(3)该反应的v正 随时间变化的关系如图。t2时改变了某种条件,改变的条件可能是___、___。(填写2项)
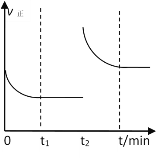
(4)实验测得t2时刻容器内有1molH2O,5min后H2O的物质的量是0.8mol,这5min内H2O的平均反应速率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。
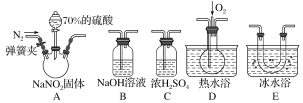
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________。
②装置E的作用是_________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】可燃冰主要含有甲烷水合物(CH4·nH2O),还含少量CO2等物质。
(1)可燃冰中,CH4分子的空间构型为_______,CO2的电子式为________
(2)工业利用甲烷制氢气,化学方程式为CH4(g) + H2O(g)CO(g) + 3H2(g)
①下列措施能加快反应速率的是_______
a.降低温度 b.增加CH4浓度 c.使用催化剂
②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是______
a.c(H2) = 3c(H2O) b.混合气体的质量不再变化 c.单位时间内生成1 mol CO,同时消耗3 mol H2
(3)某种甲烷燃料电池工作原理如图所示:
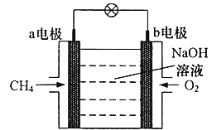
①电子移动方向为________,(填“a→b"或“b→a")
②b电极的电极反应式为____________。
(4)甲烷可催化还原NO,反应历程如图所示:

①该历程中,反应i为CH4+ 12Fe2O3=8Fe3O4+CO2+2H2O,
则反应ii的化学方程式为____________
②工业上催化还原2molNO,理论上需要______LCH4 (标准状况下)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.若2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则H2的燃烧热为241.8 kJ/mol
B.已知强酸与强碱在稀溶液里反应的中和热为57.3 kJ/mol,则H2SO4(aq)+ Ba(OH)2(aq)= BaSO4(s)+2H2O(l) ΔH =-114.6 kJ/mol
C.500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH =-38.6 kJ/mol
2NH3(g) ΔH =-38.6 kJ/mol
D.已知25℃、101kPa条件下:4Al(s)+3O2(g)=2Al2O3(s) ΔH =-2834.9 kJ/mol,4Al(s)+2O3(g)=2Al2O3(s) ΔH =-3119.1 kJ/mol,则O2比O3稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO2和NOx,易形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO2-+(____)NO+(____)OH-=(____)Cl-+(____)NO3-+______
(3)为减少SO2对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO2。
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO2的是__(填字母代号)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒的原子结构示意图为____________________________;
(2)![]() 的中心原子价层孤电子对数目为______,一个
的中心原子价层孤电子对数目为______,一个![]() 离子中含有_______个
离子中含有_______个![]() 键;
键;
(3)![]() 巯基烟酸氧钒配合物
巯基烟酸氧钒配合物![]() 图
图![]() 是副作用小的有效调节血糖的新型药物。
是副作用小的有效调节血糖的新型药物。
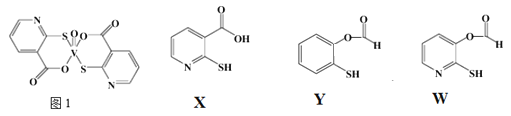
①该药物中N原子的杂化方式是_______;
②![]() 、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
、Y、W三种物质在水中的溶解性由大到小的顺序为__________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的原子个数和电子数,如苯分子中大
键的原子个数和电子数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
③下列微粒中存在“离域![]() 键”的是_____;
键”的是_____;
![]()
![]()
![]()
![]()
④![]() 分子中大
分子中大![]() 键可以表示为_______________;
键可以表示为_______________;
(5)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈如下图2所示的无限链状结构,则偏钒酸铵的化学式为_________;
(6)某六方硫钒化合物晶体的晶胞如图4所示![]()
![]() 表示V,
表示V,![]() 表示
表示![]() ,该晶胞的化学式为VS。图3为该晶胞的俯视图。
,该晶胞的化学式为VS。图3为该晶胞的俯视图。
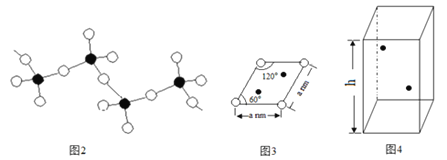
①请在图4中用![]() 标出V原子的位置;__________
标出V原子的位置;__________
②已知晶胞的密度为![]() ,计算晶胞参数
,计算晶胞参数![]() ____________cm。
____________cm。![]() 列出计算式即可
列出计算式即可![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com