
科目: 来源: 题型:
【题目】如图分别表示红磷、白磷燃烧时的能量变化,有关说法正确的是( )
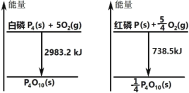
A.白磷比红磷稳定
B.白磷燃烧产物比红磷燃烧产物稳定
C.1mol 白磷转变为红磷放出 2244.7kJ 的热量
D.红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
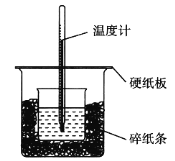
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列过程与氧化还原反应无关的是( )
A.酸性重铬酸钾用于检测酒精
B.铝粉与强碱溶液反应放热
C.植物油在空气中变质,产生“哈喇”味
D.海水经风吹日晒获得粗盐
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
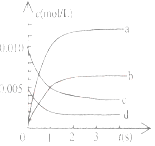
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
查看答案和解析>>
科目: 来源: 题型:
【题目】LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使 LED 灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.溶液中 SO42-向负极移动
C.铜为阳极,锌为阴极
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室从含碘废液(含有I2、I-等)中回收碘,其实验过程如下:
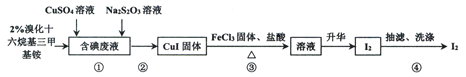
已知:溴化十六烷基三甲基铵是一种阳离子表面活性剂,可以中和沉淀表面所带的负电荷,使沉淀颗粒快速聚集,快速下沉。下列说法不正确的是
A.步骤①中Na2S2O3可用Na2SO3代替
B.步骤②可以用倾析法除去上层清液
C.含碘废液中是否含有IO3-,可用KI-淀粉试纸检验
D.步骤③发生反应的离子方程式为:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠![]() 是重要漂白剂.探究小组开展如下实验,回答下列问题:
是重要漂白剂.探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取![]() 晶体按如图装置进行制取。
晶体按如图装置进行制取。

已知:![]() 饱和溶液在低于
饱和溶液在低于![]() 时析出
时析出![]() ,高于
,高于![]() 时析出
时析出![]() ,高于
,高于![]() 时
时![]() 分解成
分解成![]() 和NaCl.
和NaCl.
(1)用![]() 双氧水配制
双氧水配制![]() 的
的![]() 溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______
溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要______![]() 填仪器名称
填仪器名称![]() ;
;
(2)装置C的作用是______;
(3)装置B内生成的![]() 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成![]() ,生成
,生成![]() 的反应方程式为______.
的反应方程式为______.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______;
(5)反应后,经以下步骤可从装置D的溶液获得![]() 晶体.请补充完整操作iii.
晶体.请补充完整操作iii.
![]() 蒸发结晶;
蒸发结晶;![]() 趁热过滤;iii.______;
趁热过滤;iii.______;![]() 低于
低于![]() 干燥,得到成品.
干燥,得到成品.
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的![]() 晶体中含少量
晶体中含少量![]() 。产生
。产生![]() 最可能的原因是______;
最可能的原因是______;
![]() 中有
中有![]() 气体产生,并有部分进入D装置内
气体产生,并有部分进入D装置内
![]() 中浓硫酸挥发进入D中与NaOH中和
中浓硫酸挥发进入D中与NaOH中和
![]() 中的硫酸钠进入到D装置内
中的硫酸钠进入到D装置内
(7)测定样品中![]() 的纯度。测定时进行如下实验:
的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:![]() ,将所得混合液稀释成100mL待测溶液。
,将所得混合液稀释成100mL待测溶液。
取![]() 待测溶液,加入淀粉溶液做指示剂,用c
待测溶液,加入淀粉溶液做指示剂,用c![]()
![]() 标准液滴定至终点,测得消耗标准溶液体积的平均值为V
标准液滴定至终点,测得消耗标准溶液体积的平均值为V![]() 已知:
已知:![]()
![]() 确认滴定终点的现象是______;
确认滴定终点的现象是______;
![]() 所称取的样品中
所称取的样品中![]() 的物质的量为______
的物质的量为______![]() 用含c、V的代数式表示
用含c、V的代数式表示![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型的污水处理剂。
(1)K2FeO4的制备:
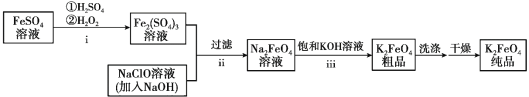
①i中反应的离子方程式是_______。
② 将ii中反应的离子方程式补充完整:____Fe3+ +____OH- +____ClO-=____FeO42-+_______+________
③ iii中反应说明溶解度:Na2FeO4_______K2FeO4(填“>”或“< ”)。
(2)K2FeO4的性质:
i. 将K2FeO4固体溶于蒸馏水中,有少量无色气泡产生,经检验为O2,液体有丁达尔效应。
ii. 将K2FeO4固体溶于浓KOH溶液中,放置2小时无明显变化。
iii. 将K2FeO4固体溶于硫酸中,产生无色气泡的速率明显比i快。
① K2FeO4溶于蒸馏水的化学反应方程式是_______。
② K2FeO4的氧化性与溶液pH的关系是_______。
(3)K2FeO4的应用。K2FeO4可用于生活垃圾渗透液的脱氮(将含氮物质转化为N2)处理。K2FeO4对生活垃圾渗透液的脱氮效果随水体pH的变化结果如下:
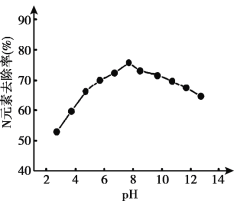
① K2FeO4脱氮的最佳pH是_____。
② 根据图推测,pH = 4时生活垃圾渗透液中含氮物质主要以______形式存在。
③ pH大于8时,脱氮效果随pH的升高而减弱,分析可能的原因:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:
CH4+ 2H2O![]() CO2+4H2,已知:
CO2+4H2,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
H2O(g)=H2O(l) △H=-44kJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式:____________。
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+ 2H2O(g)![]() CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则①平衡时,CH4的转化率为__________,H2的浓度为_________,反应共放出或吸收热量_______kJ。
②升高平衡体系的温度,混合气体的平均相对分子质量___________,密度_________。(填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气,并保持压强不变,平衡将___________(填“正向”“逆向”或“不”)移动。
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将________(填“正向”“逆向”或“不”)移动。达到新平衡后,容器内H2浓度范围为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释对应事实的离子方程式正确的是
A.FeSO4溶液中滴加NaOH溶液,静置一段时间后:Fe2++2OH一=Fe(OH)2↓
B.漂白粉溶液加入醋酸:H++ClO-=HC1O
C.AgCl悬浊液滴入Na2S溶液:2Ag++S2-=Ag2S↓
D.K2 CrO4溶液滴入硫酸溶液;2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com