
【题目】LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使 LED 灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.溶液中 SO42-向负极移动
C.铜为阳极,锌为阴极
D.如果将锌片换成铁片,则电路中的电流方向不变
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】现有下列五种溶液:盐酸、NH3·H2O、NH4HSO4、NaOH、CH3COOH。回答下列问题:
(1)将1 L pH=2的HCl溶液分别与0.01 mol· L-1的NH3· H2O溶液x L、0.01 mol· L-1的NaOH溶液y L充分反应至中性,x、y大小关系为: y_____x(填“>”“<”或“=”)。
(2)H+浓度相同的等体积的两份溶液:盐酸和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是_____(填写序号)。
①反应所需要的时间CH3COOH >HCl
②开始反应时的速率HCl>CH3COOH
③参加反应的锌粉物质的量HCl=CH3COOH
④反应过程的平均速率CH3COOH>HCl
⑤HCl溶液里有锌粉剩余
⑥CH3COOH溶液里有锌粉剩余
(3)将等体积、等物质的量浓度的NH3·H2O和NH4HSO4溶液混合后,升高温度(溶质不会分解)溶液pH随温度变化如图中的______曲线(填写序号)。

(4)室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加0.01 mol·L-1 NaOH溶液至中性,得到的溶液中:c(Na+)+c(NH4+) ______2c(SO42- )(填“>”“=”或“<”);用NH4HSO4与氢氧化钡溶液制取硫酸钡,若溶液中SO42- 完全沉淀,则反应后溶液的pH______7(填“>”“=”或“<”),该反应的离子方程式为_______________。
(5)25 ℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是________________(用离子方程式表示)。向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将_______(填“正向”“不”或“逆向”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酞,别名非诺夫他林,是制药工业原料,其结构如图所示,有关酚酞说法不正确的是

A. 分子式为C20H14O4
B. 可以发生取代反应、加成反应、氧化反应
C. 含有的官能团有羟基、酯基
D. 1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在梨、香蕉等水果中存在着乙酸正丁酯。实验室制备乙酸正丁酯的反应、装置示意图和有关数据如下:
![]()

水中溶解性 | 密度(g·cm-3) | 沸点 | 相对分子质量 | |
乙酸 | 溶于水 | 1.049 2 | 118 | 60 |
正丁醇 | 微溶于水 | 0.809 8 | 117.7 | 74 |
乙酸正丁酯 | 微溶于水 | 0.882 4 | 126.5 | 116 |
实验步骤:
Ⅰ.乙酸正丁酯的制备
在A中加入7.4 g正丁醇、6.0 g乙酸,再加入数滴浓硫酸,摇匀,放入1~2颗沸石。按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热A。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出水的体积。
Ⅱ.产品的精制
把分水器中的酯层和A中反应液倒入分液漏斗中,分别用少量水、饱和碳酸钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置后过滤,将产物常压蒸馏,收集124-126 ℃的馏分,得到5.8 g产品。请回答下列问题:
(1)冷水应从冷凝管的________(填“a”或“b”)口通入。
(2)产品的精制过程中,第一次水洗的目的是________________,第二次水洗的目的是________________,洗涤完成后将有机层从分液漏斗的________(填“上口”或“下口”)转移到锥形瓶中。
(3)本实验提高产品产率的方法是_________________________________________。
(4)判断反应终点的依据是_______________________________________________。
(5)该实验过程中,生成乙酸正丁酯的产率是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):

(1)设计装置A的目的是_____________________________________,为达此目的应进行的操作______________________________________________________。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是____________________________________________________________;B中反应的离子方程式是_____________________________________________________。
(3)将注射器F中的空气推入E中,E中的气体变为红棕色,该实验的目的是____________。
(4)D装置的作用是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置甲、乙、丙都是铁与水蒸气反应的实验装置,下列说法不正确的是
装置甲 装置乙
装置乙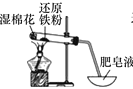 装置丙
装置丙
A.选用丙装置,实验结束时先移去酒精灯,再将导气管拿出水面
B.甲装置中氯化钙的作用是除去氢气中混有的水蒸气
C.用乙装置实验时,蒸发皿中产生大量肥皂泡,点燃肥皂泡发出爆鸣声
D.三个装置相比较,乙装置简单、操作简便、节约原料、安全性好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,四种装置中所盛有的溶液体积均为200ml,浓度均为0.6mol/L,工作一段时间后,测得导线上均通过了0.2mol电子,此时溶液中的![]() 由大到小的顺序是
由大到小的顺序是

①硫酸铜溶液 ②稀硫酸 ③氯化锌溶液 ④食盐水
A. ④②①③ B. ④③①② C. ④③②① D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:
2NaNH2+N2O═NaN3+NaOH+NH3↑
3NaNH2+NaNO3═NaN3+3NaOH+NH3↑
(1)①氮原子的L层电子排布图_____________________。
②氮所在的周期中,第一电离能最大的元素为_____________(填元素符号)。
③与N3互为等电子体的粒子为____________(写出一种)。
④氨气的电子式____________。
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因是____________
(3)依据价层电子对互斥理论,NO3-间构型呈__________形。
(4)汽车安全气囊的设计是基于反应6NaN3+Fe2O3═3Na2O+2Fe+9N2↑,生成物中的铁是一种常见物质,而铁的晶体有三种堆积方式,其中两种的堆积方式如图所示,下列有关铁及晶体的说法中正确的是_________。
A.金属铁的导电性是由于通电时产生的自由电子作定向移动
B.α﹣Fe、γ﹣Fe的堆积方式分别与钾和铜相同
C.空间利用率α﹣Fe大于γ﹣Fe
D.金属铁内部存在金属键
(5)铁的上述两种晶体(α﹣Fe:γ﹣Fe)的密度比值为___________。(写成小数,保留2位有效数字)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用方铅矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程:

已知:(1)PbS+MnO2 +4H+=Mn2++Pb2++S+2H2O
(2)PbCl2(s)+2Cl-(aq)=PbCl42-(aq) △H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是________________________________;加入物质X可用于调节酸浸液的pH值,物质X可以是_______________
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有金属杂质形成的化合物,其成分为________________(写化学式)。
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式:___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com