
科目: 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的简化核外电子排布式为__,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂,Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是___。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
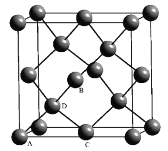

②晶胞参数,描述晶胞的大小和形状。已知单晶Ge的晶胞参数a=565.76pm,其密度为___g·cm-3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A.甲烷和氯气在光照条件下反应的产物有5种
B.2—乙基—1,3—丁二烯分子的键线式:![]()
C.分子式为C5H12O2的二元醇的主链碳原子数为3的结构有2种
D.为检验氯丙烷中的氯元素,可将氯丙烷与NaOH溶液共热几分钟后,冷却,滴加AgNO3溶液,观察是否有白色沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜
醋酸二氨合铜![]() Ⅰ
Ⅰ![]() ,氨水
,氨水![]() 吸收在生产过程中产生的CO和
吸收在生产过程中产生的CO和![]() 等气体,铜液吸收CO的反应是放热反应,其反应方程式为:
等气体,铜液吸收CO的反应是放热反应,其反应方程式为:![]() ; 完成下列填空:
; 完成下列填空:
![]() 如果要提高上述反应的反应速率,可以采取的措施是 ______
如果要提高上述反应的反应速率,可以采取的措施是 ______ ![]() 选填编号
选填编号![]()
![]() 减压
减压 ![]() 增加
增加![]() 的浓度
的浓度 ![]() 升温
升温 ![]() 及时移走产物
及时移走产物
![]() 铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
铜液中的氨可吸收二氧化碳,写出该反应的化学方程式: ______
![]() 简述铜液吸收CO及铜液再生的操作步骤
简述铜液吸收CO及铜液再生的操作步骤![]() 注明吸收和再生的条件
注明吸收和再生的条件![]() .______
.______
![]() 铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 ______ 通过比较 ______ 可判断氮、磷两种元素的非金属性强弱.
![]() 已知
已知![]() 与
与![]() 分子结构相似,
分子结构相似,![]() 的电子式是 ______
的电子式是 ______ ![]() 熔点高于
熔点高于![]() ,其原因是 ______
,其原因是 ______
![]() 提取的
提取的![]() 中含少量
中含少量![]() 、
、![]() 将产品溶解,加入
将产品溶解,加入![]() ,加热至沸,再加入
,加热至沸,再加入![]() 溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______
溶液,过滤,蒸发结晶,得到工业氯化铵.加热至沸的目的是 ______ ![]() 滤渣的主要成分是 ______ 、 ______ .
滤渣的主要成分是 ______ 、 ______ .
![]() 称取
称取![]() 小苏打样品
小苏打样品![]() 含少量
含少量![]() ,配置成250mL溶液,取
,配置成250mL溶液,取![]() 用
用![]() 盐酸滴定,消耗盐酸
盐酸滴定,消耗盐酸![]() 实验中所需的定量仪器出滴定管外,还有 ______
实验中所需的定量仪器出滴定管外,还有 ______ ![]() 选甲基橙而不选酚酞作为指示剂的原因是 ______
选甲基橙而不选酚酞作为指示剂的原因是 ______ ![]() 样品中
样品中![]() 质量分数为 ______
质量分数为 ______ ![]() 保留3位小数
保留3位小数![]()
![]() 将一定量小苏打样品
将一定量小苏打样品![]() 含少量
含少量![]() 溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______
溶于足量盐酸,蒸干后称量固体质量,也可测量定小苏打的含量.若蒸发过程中有少量液体溅出,则测定结果 ______ ![]() 选填“偏高”、“偏低”或“不受影响”
选填“偏高”、“偏低”或“不受影响”![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图1、2所示的实验。请回答相关问题。
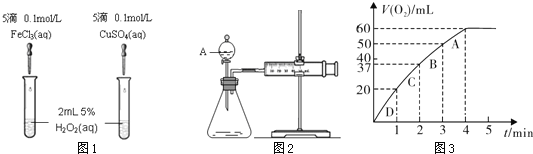
(1)定性如图1可通过观察_______,定性比较得出结论。有同学提出将FeCl3改为0.05 mol/L Fe2(SO4)3更为合理,其理由是_______。
(2)定量如图2所示,实验时均生成40 mL气体,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_________。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图3所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式________________。
②实验时放出气体的总体积是________mL。
③A、B、C、D各点反应速率快慢的顺序为:___>___>___>___。
解释反应速率变化的原因___________________。
④H2O2的初始物质的量浓度是___________(请保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:

下列叙述错误的是
A. 实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B. 装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C. 向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D. 用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α__(填“<”“>”或“=”)1×10-14,作出此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=___。
(3)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:
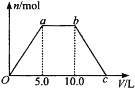
(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com