
科目: 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量)。下列说法不正确的是
![]()
A. 葡萄酒酿造时通入SO2起到了杀菌和增酸的作用
B. 反应①中若不通入N2则测得的SO2含量偏低
C. 反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度
D. 若仅将②中的氧化剂“H2O2溶液”替换为“溴水”,对测定结果无影响
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物的变化关系如图所示:
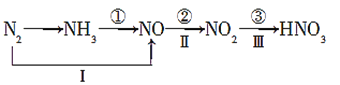
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.反应③中,NO2作氧化剂,H2O作还原剂
D.液氨可用作制冷剂,硝酸可用于制化肥、农药、炸药、染料、盐类等
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
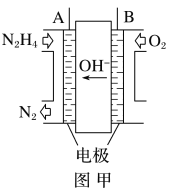
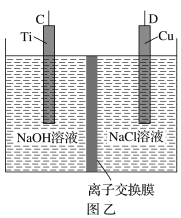
(1)上述装置中D电极应连接肼燃料电池的________极(填“A”或“B”),该电解池中离子交换膜为________离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________,
肼燃料电池中A极发生的电极反应为____________________________。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是![]()
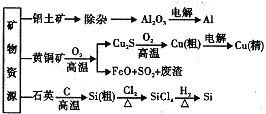
A.![]() 、
、![]() 均为共价化合物
均为共价化合物
B.生产过程中均涉及氧化还原反应
C.石英可用于制光导纤维,晶体Si常用做半导体材料
D.黄铜矿冶炼铜时产生的![]() 可用于生产硫酸,FeO可用于冶炼铁
可用于生产硫酸,FeO可用于冶炼铁
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.在熔融状态能导电的物质一定是离子化合物
B.CO2和CS2每个原子的最外层都具有8电子稳定结构
C.干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同
D.2016年IUPAC命名117号元素为Ts,Ts的原子核外最外层电子数是7,是第七周期第ⅦB族元素
查看答案和解析>>
科目: 来源: 题型:
【题目】将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A. 反应剧烈程度:两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对新制氯水的探究所得出的结论不正确的是( )
A.新制氯水使紫色石蕊先变红后褪色,说明新制氯水中含有![]() 和
和![]()
B.往新制氯水中加入硝酸酸化的![]() 溶液,有白色沉淀产生,说明新制氯水中有
溶液,有白色沉淀产生,说明新制氯水中有![]()
C.将![]() 固体加入新制的氯水中,有气泡产生,说明新制氯水显酸性
固体加入新制的氯水中,有气泡产生,说明新制氯水显酸性
D.将新制氯水置于阳光下,有气泡冒出且溶液颜色逐渐变浅,该气体一定是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】蛇纹石矿可以看作由MgO、![]() 、
、![]() 和
和![]() 组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。
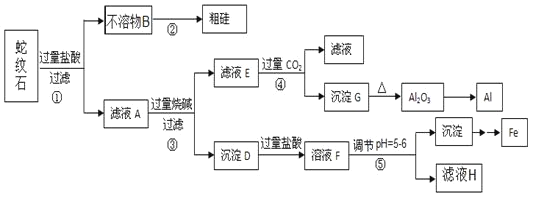
有关氢氧化物沉淀的pH见下表:
金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| 1.9 | 3.2 |
| 9.4 | 11.6 |
(1)蛇纹石中所含的氧、镁、硫、铝这几种元素的简单离子的半径由小到大的顺序_____,滤液A中含有的阳离子有 _________。
(2)硅元素在周期表中的位置______,二氧化碳的电子式___________。
(3)操作②中反应的化学方程式为 ____,操作④中生成沉淀G的离子方程式为 _____。
(4)操作⑤中调节pH到![]() 时,可以用到的试剂
时,可以用到的试剂![]() 填序号
填序号![]() ____________。
____________。
a、NaOH b、氨水 c、MgO d、Mg(OH)2
(5)从滤液H制取金属Mg的流程如下:
![]()
流程中冶炼镁的方法是__________,在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2 (g) ![]() CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。

(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______(选填“增大”、“减小”或“不变”)。
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_____点(选填“D”、“E”或“F”)。
(3)由图2可知该反应的△H_____0(选填“>”、“<”或“=”,下同),压强pl____p2;当压强为p2时,在y点:v(正)____v(逆)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界____。
(2)表中最活泼的金属与最活泼的非金属形成的物质是___(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:___,这两种化合物中所含的化学键有____(填字母)。
A.极性共价键 B.非极性共价键 C.离子键
(4)e、f、k、m对应的单原子离子的半径由大到小的顺序为____(填离子符号)。
(5)d、m对应的离子还原性由强到弱顺序为____(填离子符号)。
(6)d、e、m、p的气态氢化物中,最不稳定的是(填分子式)____。
(7)用电子式表示n与m形成的原子个数比2∶1的化合物的形成过程:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com