
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B.一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;否则y<4
D.相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为:0.2mol/L、0.1mol/L和0.2mol/L。当反应达到平衡时可能存在的数据正确的是
A. c(O2)=0.2mol/LB. c(SO2)=0.25mol/L
C. c(SO2)+c(SO3)=0.3mol/LD. c(SO2)=c(SO3)=0.15mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO.其实验流程图如下:

(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100mL溶液中取出25.00mL溶液,用0.1molL-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示.在B容器中生成硝酸的物质的量为_________mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为_________mL。
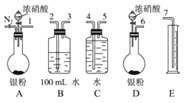
(2)测定NO的体积
①从如图3所示的装置中,你认为应选用_________装置进行Ag与浓硝酸反应实验,选用的理由是_________。
②选用如图3所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_________(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中_________(填“有”或“没有”)NO产生,作此判断的依据是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究。
i. 下图是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。
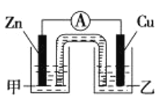
①该原电池的正极为 ____ ,其外电路中的电子是从____ 极(填“Zn”或“Cu”)流出。
②电解质溶液乙是______溶液,Zn极的电极反应式是_______ 。
③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是_____。
ii. 下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。
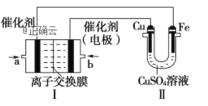
①同学想在Ⅱ中实现铁上镀铜,则Cu作____极,电极反应式为______,当线路中有0.1mol电子通过时,阴极增重_____ g。Ⅰ中消耗氧气体积是_____L(标况下)。
②a处通入的是____(填“CH4”或“O2”),b处电极上发生的电极反应式是___。Ⅰ中的总反应方程式为___。
③该同学若将Ⅱ中的两个电极都换成铂电极,当线路中有0.1mol电子通过时,测得溶液pH=______(100mL的CuSO4溶液),则Ⅱ中的总反应方程式为 _______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理部分含硫废水。某小组在实验室中利用下列装置制备ClO2(此制备方法中经空气稀释的SO2与ClO2不反应)。
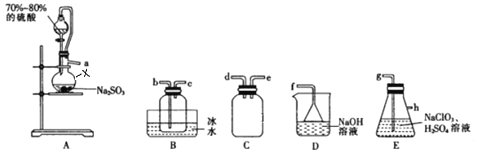
回答下列问题:
(1)仪器X的名称是__________________________。
(2)欲选择上图中的装置收集ClO2,其连接顺序为a→______(按气流方向,用小写字母表示)。
(3)装置C的作用是_________,装置E中反应的离子方程式为__________________________________。
(4)处理含硫(Na2S)碱性废水时,ClO2与Na2S反应(S2-被氧化为SO42-)的离子方程式为_________________;处理含硫碱性废水时,相同条件下同体积的ClO2相对于Cl2的优点是______________________________。
(5)ClO2很不稳定,需现用现配,为测定所得溶液中ClO2的含量,进行下列实验:
步骤1:准确量取V1 mL ClO2溶液加入锥形瓶中。
步骤2:用稀硫酸调节ClO2溶液的pH≤2.0,再加入足量KI晶体,静置片刻。
步骤3:加入指示剂,用c mol·L-1的Na2S2O3标准溶液滴定至终点时,消耗V2 mL Na2S2O3标准溶液。
(已知:2ClO2+8H++10I-===2C1-+5I2+4H2O;2S2O32-+I2===2I-+S4O62-)原溶液中ClO2的含量为____________(用含c、V1、V2的代数式表示)g·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4L氯仿中含有的氯原子数目为3NA
B.1mol羟基中含有的电子数为10NA
C.常温常压下,50gC7H16分子中含有的共价键数目为11NA
D.14g乙烯与2-丁烯混合物中含有碳原子数目为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是![]()
A.洪涝、地震灾区灾后常用石灰对环境进行消毒,是利用石灰可使蛋白质变性的性质
B.食品添加剂对人体均有益,因此在添加时无需对其用量进行严格控制
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.根据分散系的稳定性,将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目: 来源: 题型:
【题目】向体积为 1L 的恒温恒容密闭容器中充入 2molA,发生反应:A(g)![]() B(g)+C(g)。若A的浓度由2mol/L降至0.8 mol/L 需20s,则B的浓度由1.2mol/L升至1.8mol/L所需的反应时间为
B(g)+C(g)。若A的浓度由2mol/L降至0.8 mol/L 需20s,则B的浓度由1.2mol/L升至1.8mol/L所需的反应时间为
A.大于 10sB.10sC.小于 10sD.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】现有室温下浓度均为0.01mol/L的几种溶液:①盐酸 ②醋酸③氨水④ NaOH溶液。回答下列问题:
(1)②的电离方程式为________ ; ③,④中水的电离程度较大的是______
(2)室温下,溶液①中由水电离产生c(H+)=______;当温度升高到100摄氏度时,(Kw=1×10-12)溶液④的pH= ______
(3)将①、③等体积混合,所得溶液呈______ (填酸,碱或中)性。
(4)将②、④等体积混合后,若溶液呈中性,则消耗两溶液的体积为②_____ ④(填“>”、“<”或“=”)
(5)室温时,若用标准溶液①滴定④,滴定过程中,需要加入_______作指示剂,滴定终点的判断方法是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸钠是一种基础化工原料。
(1)已知:Cl2(g)+2OH-(aq)=ClO-(aq)+Cl-(aq)+H2O(l) ΔH=-186 kJ·mol-1,3ClO-(aq)=ClO3— (aq)+2Cl-(aq) ΔH=-113 kJ·mol-1,则:3Cl2(g)+6OH-(aq)=ClO3—(aq)+5Cl-(aq)+3H2O(l)ΔH=____kJ·mol-1,该反应中生成1molClO3—,转移电子数为____。
(2)工业上采用无隔膜电解饱和食盐水可制备氯酸钠。该工艺过程中,生成氯酸钠的相关反应为:Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-,2HClO+ClO-=ClO
H++ClO-,2HClO+ClO-=ClO![]() +2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
+2H++2Cl-。已知:溶液中,Cl2、HClO、ClO-的物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图。
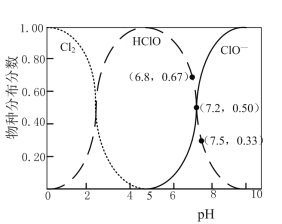
①电解过程中,为按化学计量数比反应,需控制电解液的pH约为___(填序号)。
A.5 B.6.8 C.7.2D.7.5
②若电解液碱度过大,阳极会有较多的O2放出,电极反应方程式为____。已知:Cr2O72—+H2O![]() 2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
2CrO42—+2H+,电解时向食盐水中加入的重铬酸钠(Na2Cr2O7)可以防止电解液碱度过大,其原理是____。
③若电解液pH<5时,溶液中HClO浓度会随pH减小迅速降低,其原因是____(用离子方程式表示)。
(3)电解时须对电解槽进行冷却处理以防止电解液温度过高的原因是____。
(4)氯酸钠与硫酸酸化的双氧水溶液反应常用于制备饮用水消毒剂ClO2(g),该反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com