
科目: 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰。海水冻结时,部分来不及流走的盐分以卤汁的形式被包围在冰晶之间,形成“盐泡”![]() 假设盐分以一个NaCl计
假设盐分以一个NaCl计![]() ,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )
,其大致结构如下图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是( )

A.海冰内层“盐泡”越多,密度越小
B.海冰冰龄越长,内层的“盐泡”越多
C.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
D.海冰内层NaCl的浓度约为![]() 设冰的密度为
设冰的密度为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJ·mol-1。假设每摩尔水中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B.实验检测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ·mol-1、-3747kJ·mol-1和-3265kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键
C.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=![]() 。若加入少量CH3COONa固体,则电离平衡CH3COOHCH3COO-+H+向左移动,α减小,Ka变小
。若加入少量CH3COONa固体,则电离平衡CH3COOHCH3COO-+H+向左移动,α减小,Ka变小
D.“水”电池是一种能利用淡水与海水之间含盐量差别进行发电的装置,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。则每生成1molNa2Mn5O10转移2mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
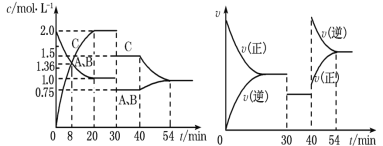
下列说法中正确的是( )
A.30min~40min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30min时降低温度,40min时升高温度
D.8min前A的平均反应速率为0.08mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】己二酸是重要的有机合成中间体,是重要的化工原料。己二酸的物理常数如表所示:
物质 | 色态 | 相对分子质量 | 熔点/℃ | 溶解度(性) | |||
g/100mL水 | 乙醇 | ||||||
己二酸 | 白色晶体 | 146 | 152 | 15℃ | 25℃ | 100℃ | 易溶 |
1.4 | 2.3 | 160 | |||||
Ⅰ.制备己二酸的一种反应机理如下:
![]() +HNO3(浓)
+HNO3(浓)![]() HOOC(CH2)4COOH+NO2↑+H2O(未配平)
HOOC(CH2)4COOH+NO2↑+H2O(未配平)
制备己二酸的装置如图所示(夹持、加热装置省略)。

(1)向三颈烧瓶中加入2mL浓HNO3,再缓慢滴加1mL环己醇,保持80℃持续反应2h。仪器b的名称是______________,能否用于蒸馏冷凝: ____________(填“能”或“否”)。反应结束冷却至室温后,在冰水浴中冷却,分离出己二酸粗品,用冰水浴的目的是__________
(2)图中装置的缺陷为____________________。
Ⅱ.用浓HNO3做氧化剂的合成方法中,浓HNO3会严重腐蚀设备。科学家改进了合成已二酸的方法,改进后的反应机理如下:
![]()
![]() HOOC(CH2)4COOH
HOOC(CH2)4COOH
(环己烯,难溶于水,易溶于乙醇),使用的装置如图所示(夹持、加热装置省略)。

(3)仪器c与a相比较,优点在于___________。
(4)检验己二酸粗产品中含有少量环己烯时的方法_________。
(5)实验结束后,准确称取实验产品0.1500g于250mL锥形瓶中,加入50mL热的蒸馏水,搅拌溶解,滴加几滴酚酞。用0.1000molL-1 NaOH溶液滴定。重复上述操作两次,消耗NaOH的平均体积为20.00mL。
①滴定终点的现象为__________。
②产品的纯度为______________(保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图是一个化学过程的示意图。
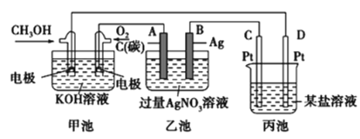
①乙池中总反应的离子方程式____________。
②电解一段时间后,向乙池的溶液中加入________________可恢复为原溶液。
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出负极的电极反应式:___________。
②图中X溶液是________。
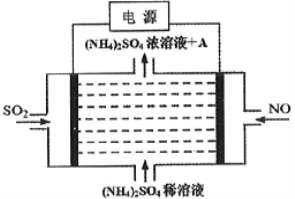
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为_____________,阴极的电极反应式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
3Z(g) △H=-akJ·mol-1(a>0),下列说法不正确的是
A. 0.1molX和0.2molY充分反应生成Z的物质的量一定小于0.3mol
B. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达a Kj
D. 升高反应温度,逆反应速率增大,正反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com