
科目: 来源: 题型:
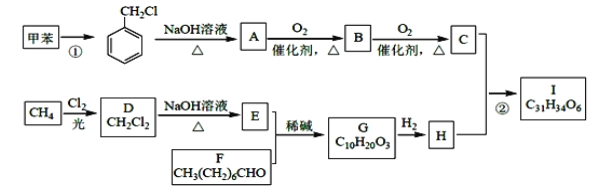
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
已知:a、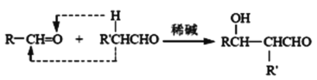
b、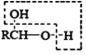
![]() RCHO
RCHO
回答下列问题:
(1)反应①所需试剂、条件分别是____________;A的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)E的结构简式为______________;I 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件①遇FeCl3 溶液显紫色;②能发生银镜反应,W 的可能结构有____种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式________。
(5)设计用甲苯和乙醛为原料制备 ![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为A
的合成路线,其他无机试剂任选(合成路线常用的表示方式为A![]() B
B![]() 目标产物。____________
目标产物。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目: 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时0.10mol/L草酸钠溶液中存在多个平衡,其中有关说法正确的是(已知室温时,Ksp(CaC2O4)=2.4×10-9)( )
A.若将溶液不断加水稀释,则水的电离程度增大
B.溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-)
C.若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a
D.向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8mol/L时即能产生沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如下实验测量mg铜银合金样品中铜的质量分数:

下列说法不正确的是![]()
A.收集到的VL气体都是NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.根据题中已知条件不能求出合金中铜的质量分数
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验不能达到预期目的的是
选项 | 实验操作 | 预期目的 |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有 1 mL 硝酸银溶液的试管中滴加 NaCl 溶液至不再有沉淀产生,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
C | 苯酚和水的浊液中,加稍过量浓碳酸钠溶液 | 比较苯酚与碳酸的酸性 |
D | 向2支试管中加入同体积同浓度H2C2O4溶液, 再分别加入同体积不同浓度的酸性KMnO4溶液 | 依据褪色时间来研究浓度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)ClO2可将废水中的CN-氧化成CO2和N2,该反应的离子方程式是_______。
(2)根据文献资料,用NaClO3和双氧水在酸性条件下可制得ClO2。某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。
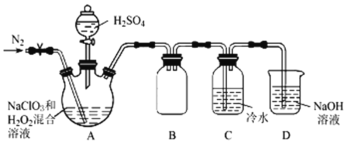
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式是_____。
(3)测定装置C中ClO2溶液的浓度:取10.00 mL C中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入____________作指示剂,用0.1000 mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2 + 2S2O32-=2I-+ S4O62-),消耗标准溶液的体积为20.00 mL。滴定终点的现象是________,C中ClO2溶液的浓度是__________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化钛(TiO2)广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备乙酸、钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到胶体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为______;
②检验TiO2·x H2O中Cl-是否被除净的方法是___________
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
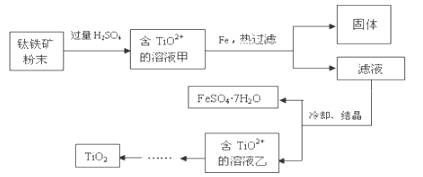
(2)溶液甲中加入Fe的作用是__________
(3)若要加热FeSO4.7H2O晶体得无水硫酸亚铁,除酒精灯、玻璃棒外,还要用到的两种硅酸盐质仪器是__________
Ⅱ.二氧化钛的用途:
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
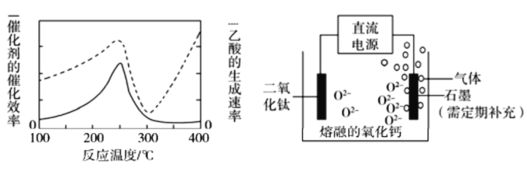
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示(实线表示的是催化剂的催化效率,虚线表示的是乙酸的生成速率),250~300 ℃时,温度升高而乙酸的生成速率降低的原因是______。
(5)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氧化钙,原理如图所示,二氧化钛电极连接电源_____(填“正极”或“负极”),该极电极反应式为__________。石墨极上石墨参与反应产生的气体是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氯气跟水反应Cl2+H2O=2H++Cl-+ClO-
B.二氧化锰跟浓盐酸共热制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
D.向稀漂白粉溶液中通入足量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com