
科目: 来源: 题型:
【题目】有机物M的相对分子质量不超过150,经测定M具有下列性质:
①能燃烧,燃烧产物只有CO2和H2O
②M与醇或羧酸在浓硫酸存在下均能生成有香味的物质
③在一定条件下,M能发生分子内脱水反应,其生成物与溴水混合,溴水褪色
④0.1molM与足量NaHCO3溶液反应产生4.48L(标准状况下)气体
下列物质与M互为同系物的是( )
A.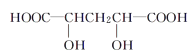 B.
B.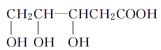
C.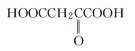 D.
D.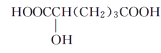
查看答案和解析>>
科目: 来源: 题型:
【题目】有机锗具有抗肿瘤活性,锗元素的部分信息如右图。则下列说法不正确的是

A. x=2
B. 锗元素与碳元素位于同一族,属于ⅣA族
C. 锗位于元素周期表第4周期,原子半径大于碳的原子半径
D. 距离锗原子核较远区城内运动的电子能量较低
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应。
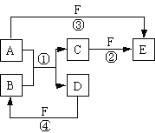
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是___。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是___。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则C的电子式是___,反应③的化学方程式是___。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是___,反应④的化学方程式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
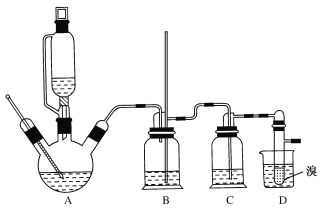
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是制造新型信息材料的中间体,B是制备血管紧张素抑制剂卡托普利的原料,它们有如下的转化关系:
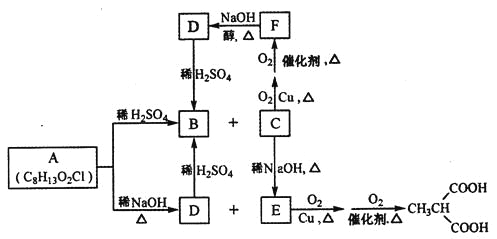
试回答下列问题:
(1)B的名称是______________,C含有的官能团名称是_____________。
(2)C→E的反应类型是_____________,C→F的反应类型是______________。
(3)A的结构简式为____________。
(4)写出与F具有相同官能团的F的所有同分异构体_____________(填结构简式)
(5)已知![]() ,请以2一甲基丙醇和甲醇为原料,设计制备有机玻璃(聚甲基丙烯酸甲酯)的合成路线.合成路线流程图示例如下:___________________
,请以2一甲基丙醇和甲醇为原料,设计制备有机玻璃(聚甲基丙烯酸甲酯)的合成路线.合成路线流程图示例如下:___________________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化镁常用于制备其它超硬、高导热、耐高温的氮化物,实验室用以下装置制取氮化镁。已知:Mg+2NH3![]() Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
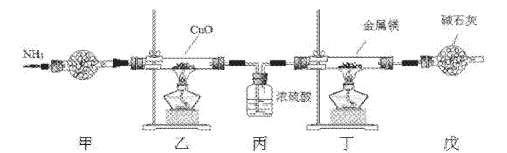
A. 实验开始时应先点燃乙处酒精灯,再点燃丁处酒精灯
B. 装置乙的目的是制备N2
C. 装置丙与装置戊可以对调
D. 取装置丁所得固体少许,滴入少量蒸馏水,可检验是否有Mg3N2
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是___(填编号),该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
(2)实验中用左手控制___,眼睛注视___,直至滴定终点。判断滴定终点的现象是:锥形瓶中溶液___。
(3)如图是某次滴定时的滴定管中的液面,其读数为___mL。
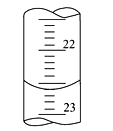
(4)根据下列数据:请计算待测盐酸溶液的浓度为___mol/L。
滴定次数 | 待测液体积(mL) | 标准液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.42 | 20.40 |
第二次 | 20.00 | 2.28 | 22.30 |
第三次 | 20.00 | 0.20 | 22.60 |
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知![]() ,三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
,三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
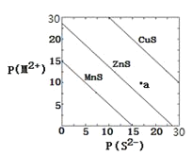
A.a点无ZnS沉淀生成
B.可用MnS除去![]() 溶液中混有的少量
溶液中混有的少量![]()
C.向CuS悬浊液中加入少量水,平衡向溶解的方向移动,![]() 增大
增大
D.该温度下,MnS的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com